Fundamentos de química
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 7162

- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 5942
 La materia es todo lo que tiene una masa y ocupa un espacio. La masa es la medida de la cantidad de materia que posee un cuerpo. La fuerza necesaria para acelerar un cuerpo aumenta con la masa de éste (segunda ley de Newton).
La materia es todo lo que tiene una masa y ocupa un espacio. La masa es la medida de la cantidad de materia que posee un cuerpo. La fuerza necesaria para acelerar un cuerpo aumenta con la masa de éste (segunda ley de Newton).- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 9728
 En todo proceso físico o químico no se produce cambio en la cantidad de materia. Para una reacción química, la suma de las masas de los reactivos deben ser igual a la suma de las masas de los productos.
En todo proceso físico o químico no se produce cambio en la cantidad de materia. Para una reacción química, la suma de las masas de los reactivos deben ser igual a la suma de las masas de los productos.- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 7519
 Enunciado del principio de conservación de la energía: “La energía no puede crearse ni destruirse en una reacción química o proceso físico. Sólo puede convertirse de una forma en otra”
Enunciado del principio de conservación de la energía: “La energía no puede crearse ni destruirse en una reacción química o proceso físico. Sólo puede convertirse de una forma en otra”El principio de conservación de la energía, también conocido como la primera ley de la termodinámica, establece que la energía total de un sistema aislado se mantiene constante si no hay transferencia de energía hacia o desde el sistema en forma de trabajo o calor. En otras palabras, la energía no puede ser creada ni destruida, solo transformada de una forma a otra.
Matemáticamente, el principio de conservación de la energía se expresa como:
Energía total del sistema=Energía cinética+Energía potencial+Energía interna
Esta ecuación tiene en cuenta diversas formas de energía, como la energía cinética asociada al movimiento, la energía potencial relacionada con la posición en un campo de fuerza (como la gravedad), y la energía interna, que representa la energía asociada al movimiento de partículas a nivel molecular.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 18474
La Ley de Conservación de la Materia y la Energía: Pilares Fundamentales de la Física y la Química
La Ley de Conservación de la Materia y la Energía son dos principios esenciales que rigen el comportamiento de la naturaleza a niveles micro y macroscópicos. Ambas leyes son fundamentales en la física y la química, proporcionando una base conceptual para comprender una amplia gama de fenómenos y procesos en el universo.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 5856
 La materia puede clasificarse en tres estados claramente diferenciados.
La materia puede clasificarse en tres estados claramente diferenciados. La materia, la sustancia fundamental que compone todo lo que nos rodea, existe en diversos estados, cada uno con propiedades únicas y comportamientos distintivos. En este artículo, nos embarcaremos en un fascinante viaje a través de los estados de la materia, explorando los sólidos, líquidos y gases, comprendiendo sus características, cambios de fase y aplicaciones en el mundo cotidiano.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 15354
En el fascinante mundo de la química y la física, las propiedades de la materia se clasifican en dos categorías principales: propiedades físicas y químicas. Estas propiedades ofrecen una visión profunda de cómo interactúa y se comporta la materia en diversas circunstancias. Vamos a explorar estas dos categorías y entender su importancia en el estudio de la materia.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 18455
 Un cambio químico es un proceso en el que una o más sustancias se combinan para generar nuevos compuestos, con propiedades químicas diferentes a los reactivos de partida. Los procesos químicos llevan asociados intercambios de energía.
Un cambio químico es un proceso en el que una o más sustancias se combinan para generar nuevos compuestos, con propiedades químicas diferentes a los reactivos de partida. Los procesos químicos llevan asociados intercambios de energía.En el estudio de la materia, los cambios físicos y químicos son conceptos fundamentales que describen las transformaciones que pueden experimentar los materiales. Estos cambios son esenciales para comprender la naturaleza de la materia y su comportamiento en diversas condiciones. Vamos a explorar las diferencias entre los cambios físicos y químicos, sus ejemplos y su importancia en la ciencia.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 6457
 Las mezclas son combinaciones de sustancias puras. Cada sustancia conserva sus propiedades físicas y químicas en la mezcla. Por ejemplo, si echamos en un vaso 50 ml de metanol y 50 ml de agua se obtiene una mezcla, en ella tanto el metanol como el agua conservan sus propiedades.
Las mezclas son combinaciones de sustancias puras. Cada sustancia conserva sus propiedades físicas y químicas en la mezcla. Por ejemplo, si echamos en un vaso 50 ml de metanol y 50 ml de agua se obtiene una mezcla, en ella tanto el metanol como el agua conservan sus propiedades. - Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 3493
 La química se basa en la observación y experimentación, tratando de obtener una serie de resultados que en muchos casos se pueden expresar de forma numérica, permitiendo su comparación con los obtenidos en otras experiencias.
La química se basa en la observación y experimentación, tratando de obtener una serie de resultados que en muchos casos se pueden expresar de forma numérica, permitiendo su comparación con los obtenidos en otras experiencias.- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 3087
En notación científica el número 0.000005 se expresa como 5 × 10-6,
Notación Científica: Simplificando Números a Escala Cósmica y Microscópica
La notación científica es una forma eficiente de expresar números extremadamente grandes o pequeños mediante el uso de potencias de 10. Esta notación simplifica la escritura y manipulación de cifras que, de otra manera, serían engorrosas. Entender cómo utilizar la notación científica es esencial en diversos campos, desde la ciencia y la ingeniería hasta la astronomía y la física. Exploraremos los principios básicos de la notación científica y cómo aplicarla.
Principios Básicos de la Notación Científica
1. Formato General:
La notación científica se representa como a×10n, donde a es un número mayor o igual a 1 y menor que 10 (coeficiente), y n es un exponente entero.
2. Expresión de Números Grandes:
Para expresar números grandes, se utiliza un exponente positivo. Por ejemplo, 450,000,000450,000,000 se expresaría como 4.5×108.
3. Expresión de Números Pequeños:
Para expresar números pequeños, se utiliza un exponente negativo. Por ejemplo, 0.0000023 se expresaría como 2.3×10−6.
Cómo Convertir Números a Notación Científica
Ejemplo 1: Convertir 6,720,000 a notación científica.
Determinar el Coeficiente (a): a es 6.726.72, que es el número obtenido al trasladar la coma decimal dos lugares hacia la izquierda.
Determinar el Exponente (n): n es 6, ya que movimos la coma decimal dos lugares hacia la izquierda.
Por lo tanto, 6,720,000 en notación científica es 6.72×106.
Ejemplo 2: Convertir 0.000000045 a notación científica.
Determinar el Coeficiente (a): a es 4.5, que es el número obtenido al trasladar la coma decimal siete lugares hacia la derecha.
Determinar el Exponente (n): n es −7, ya que movimos la coma decimal siete lugares hacia la derecha.
Por lo tanto, 0.000000045 en notación científica es 4.5×10−7.
Operaciones con Notación Científica
Las operaciones con números en notación científica son directas, ya que simplemente se aplican las reglas de las potencias de 10.
Por ejemplo: 2.5×104 multiplicado por 3.2×10−2 es igual a 8.0×102.
Aplicaciones Prácticas de la Notación Científica
-
Ciencia y Investigación:
- Facilita la representación de medidas extremadamente grandes o pequeñas en campos como la biología, la física y la química.
-
Ingeniería y Tecnología:
- Simplifica los cálculos en campos como la electrónica, la mecánica y la ingeniería civil al manejar números en escalas diversas.
-
Astronomía:
- Se utiliza para expresar distancias astronómicas y tamaños de objetos en el universo.
-
Medicina:
- Facilita la expresión de tamaños microscópicos, como el tamaño de células y moléculas.
Conclusión: Simplificando el Mundo de los Números
La notación científica es una herramienta poderosa para simplificar la representación de números en escalas cósmicas y microscópicas. Facilita la comunicación y el cálculo en campos que lidian con magnitudes extremas. Al comprender los principios básicos y aplicar la notación científica, los científicos, ingenieros y estudiantes pueden maniobrar eficientemente a través de números vastos y pequeños, haciendo que las complejidades numéricas sean más accesibles y manejables.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 3012
Los resultados obtenidos en una medida no son exactos. Toda medida implica una estimación. Por ejemplo, supongamos que necesitamos medir un objeto con una regla graduada en milímetros. Al medir obtenemos un resultado comprendido entre 38 y 39 milímetros, estimamos que el objeto mide 38,5 milímetros. Este resultado tiene una parte exacta 38 y una parte que es estimada (aproximada) que es el última dígito 5. El número 38,5 mm contiene tres cifras significativas. El último dígito es dudoso, pero se considera como cifra significativa. Al dar el resultado de una medida incluimos un dígito aproximado, pero sólo uno.
A continuación utilizaremos una probeta para medir volúmenes de líquidos. A la derecha de la probeta se amplían las líneas de calibración. En la escala derecha nos movemos de 10 ml en 10 ml. La escala izquierda está graduada de modo que varia de mililitro en mililitro. 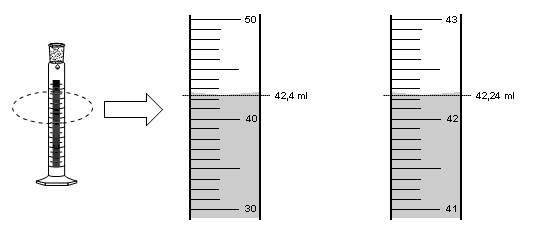
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 3029
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 4594
Supongamos que 8,56 es el resultado de una operación realizada con la calculadora. Si el número de cifras significativas es sólo dos, deberíamos dar como resultado 8,5. Pero como el tercer dígito es mayor de 5 se redondea a 6 el segundo dígito. El resultado final es 8,6.
Cuando el número que se elimina es menor que 5, el dígito precedente no cambia. En caso de que sea 5 el número que se elimina, se sustituye el dígito precedente por la cifra par más próxima.
Veamos ejemplos:
8,48 redondea a 8,5; 2,43 redondea a 2,4; 2,45 redondea a 2,4; 2,35 redondea a 2,4.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 22166
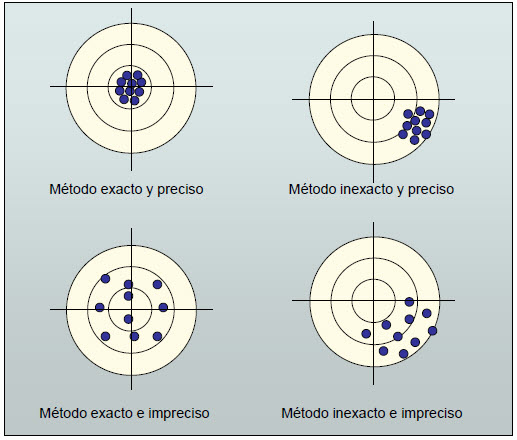
La exactitud nos da el grado de concordancia entre el valor medido y el verdadero.
La precisión está relacionada con la reproductibilidad de las medidas. Indica el grado de concordancia de varias medidas individuales.
Una balanza puede ser muy precisa, si al hacer varias medidas da siempre el mismo resultado. Pero es inexacta, si ese resultado no concuerda con la realidad. Por tanto, a los instrumentos de medida debe exigírseles que sean exactos y precisos al mismo tiempo.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 2399
Los factores de conversión se basan en multiplicar por fracciones que tienen en numerador y denominador la misma cantidad pero en diferentes unidades. Algunos ejemplos de factores unidad son los siguientes: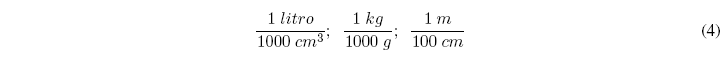
En los factores de conversión, las unidades nos guían en los cálculos. Todas las unidades se van cancelando hasta llegar al resultado buscado.
Veamos una aplicación de los factores de conversión: Sabiendo que un ergio equivale a 1 10-7 julios. Convertir 3,74 10-2 ergios en julios.
La solución se puede obtener aplicando factores de conversión: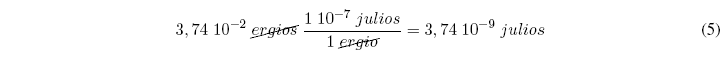
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 16848
La densidad se define como la masa por unidad de volumen. Se obtiene dividiendo la masa de una muestra entre su volumen.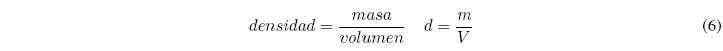
Las unidades más utilizadas son g/cm3, g/ml y también g/l. Dado que cada sustancia tiene una densidad única, se puede emplear este dato para identificar sustancias.
La densidad relativa relaciona la densidad de la sustancia con la del agua, ambas a la misma temperatura.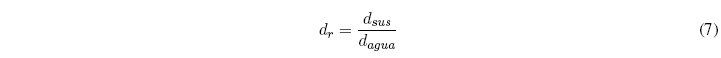
Hasta los 25ºC podemos tomar como densidad del agua 1g/ml. Por tanto, a temperatura ambiente la densidad de una sustancia coincide con su densidad relativa. A temperaturas más elevadas la densidad del agua discrepa de 1g/ml y dejan de coincidir ambas magnitudes.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Fundamentos de química
- Visto: 6188
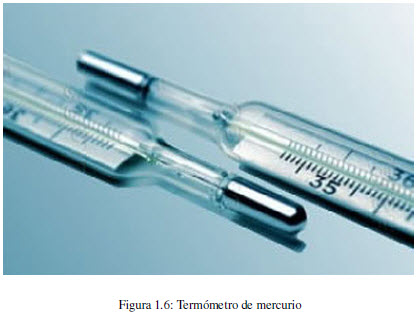 El calor es una forma de transferencia de energía, que se produce en virtud de una diferencia de temperaturas. El flujo de calor siempre se produce desde el cuerpo caliente hacia el frío.
El calor es una forma de transferencia de energía, que se produce en virtud de una diferencia de temperaturas. El flujo de calor siempre se produce desde el cuerpo caliente hacia el frío.
La temperatura de un cuerpo puede medirse con termómetros de mercurio, que consisten en un depósito para el mercurio unido a un capilar. Al calentarse el depósito el mercurio se expande por el capilar. A mayor temperatura se observa una mayor subida del mercurio.
Para poder medir temperaturas es necesario contar con una escala de temperaturas. El astrónomo sueco Anders Celsius desarrolló la denominada escala Celsius de temperatura. Toma como puntos de referencia la fusión del agua, a la que asigna 0º Celsius, y su punto de ebullición a presión atmosférica, al que asigna 100º Celsius. Entre estos puntos hay cien divisiones, cada una representa un grado Celsius.
Una escala de temperaturas muy utilizada en Estados Unidos, es la Fahrenheit. En esta escala los puntos de congelación y ebullición del agua se toman como 32ºF y 212ºF.



