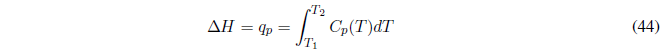Primer principio | Termodinámica
- Detalles
- Escrito por: Germán Fernández
- Categoría: Primer principio de la termodinámica
- Visto: 1794
En esta sección estudiaremos una nueva función de estado, la energía interna U, y su relación con el calor y el trabajo. Otra función de estado importante en química es la entalpía H. También se introducirán las capacidades caloríficas a presión y volumen constante, Cp y Cv, que nos dan las variaciones de la energía interna y la entalpía con la temperatura.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Primer principio de la termodinámica
- Visto: 6883
Igual que en mecánica clásica el trabajo se define por la ecuación dw = Fxdx, donde Fx es la componente de la fuerza F en la dirección del movimiento y dx es el desplazamiento. Cuando Fx y dx tienen el mismo sentido el trabajo es positivo, si tienen sentidos opuestos el trabajo es negativo.
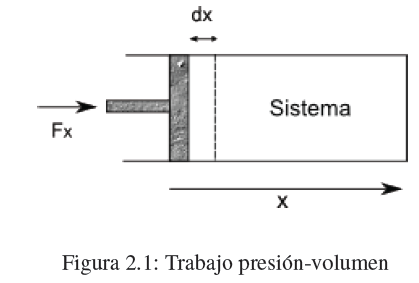
Consideremos un cilindro con un pistón sobre el que actúa una fuerza Fx produciendo un desplazamiento del pistón dx. El trabajo realizado sobre el sistema viene dado por la ecuación, dw =Fxdx. Sea A el área del pistón, la presión ejercida por el pistón sobre el sistema será, P=Fx/A, sustituyendo en la expresión del trabajo, dw = PAdx.
El producto Adx representa la variación de volumen producida por el movimiento del pistón dV=-Adx. Sustituyendo en dw nos queda:![]()
Si realizamos trabajo sobre el sistema (compresión) dV<0 y el trabajo es positivo. Cuando el sistema realiza trabajo sobre el entorno (expansión) dV>0 el trabajo es negativo.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Primer principio de la termodinámica
- Visto: 2889
El calor es la segunda forma de transferencia de energía que vamos a estudiar. Cuando dos cuerpos a diferente temperatura se ponen en contacto a través de una pared térmicamente conductora se produce un flujo de calor desde el cuerpo caliente hacia el frío hasta igualar las temperaturas.
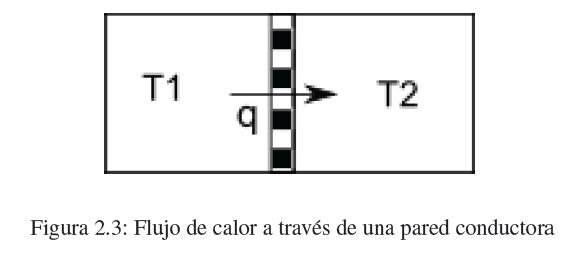
La cantidad de calor necesaria para elevar la temperatura del sistema en un dT viene dada por la expresión:
![]()
donde m es la masa del sistema y cp su calor específico a presión constante.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Primer principio de la termodinámica
- Visto: 2785
¿Cómo podemos cambiar la energía interna de un sistema? El cambio de energía interna de un sistema se produce por intercambios de calor y/o trabajo. Al realizar trabajo o aportar calor a un sistema aumentamos su energía interna. Si el sistema cede calor o realiza trabajo sobre los alrededores disminuye su energía interna.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Primer principio de la termodinámica
- Visto: 2342
La entalpía H de un sistema termodinámico se define como:![]()
La importancia de esta magnitud en química radica en el hecho de que su variación coincide con el calor intercambiado a presión constante. Es muy habitual que una reacción química se realice en un recipiente abierto (a presión atmosférica) y el calor intercambiado será un cambio de entalpía.
Partimos del primer principio de la termodinámica: ![]() , el subíndice p indica presión constante.
, el subíndice p indica presión constante.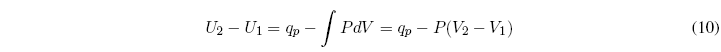
- Detalles
- Escrito por: Germán Fernández
- Categoría: Primer principio de la termodinámica
- Visto: 2476
La capacidad calorífica de un sistema cerrado en un proceso infinitesimal se define como el cociente entre el calor intercambiado y el cambio de temperatura producido.
Para un proceso a P=cte la capacidad calorífica viene dada por la ecuación: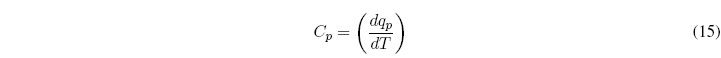
De igual manera se define la capacidad calorífica a volumen constante: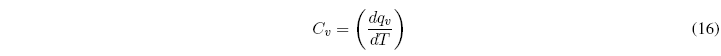
Como ![]() , las ecuaciones anteriores pueden escribirse como:
, las ecuaciones anteriores pueden escribirse como: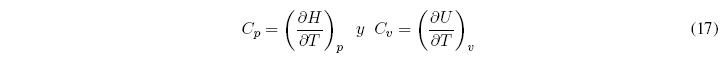
Por tanto, Cp y Cv nos dan la variación de U y H con respecto a la temperatura y siempre deben tomar valores positivos.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Primer principio de la termodinámica
- Visto: 2006
Un gas ideal cumple la ecuación de estado PV = nRT. Las interacciones entre moléculas del gas son despreciables, es decir, no existen fuerzas intermoleculares. En un gas ideal el cambio de volumen no afecta a la energía interna siempre que se mantenga la temperatura constante. Una disminución de volumen provoca que las moléculas se encuentren más cercanas, pero como no existen interacciones entre ellas la energía interna no se modifica.
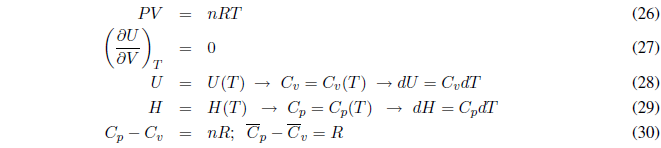
- Detalles
- Escrito por: Germán Fernández
- Categoría: Primer principio de la termodinámica
- Visto: 2044
Durante este proceso la temperatura se mantiene constante. Como la energía interna de los gases ideales sólo depende de la temperatura: \(\Delta U=0\) y \(\Delta H=0\).
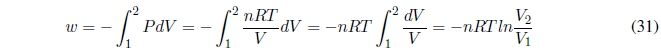
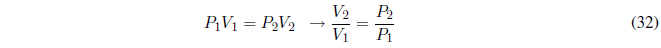
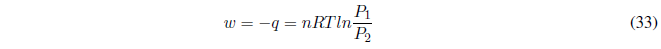
- Detalles
- Escrito por: Germán Fernández
- Categoría: Primer principio de la termodinámica
- Visto: 1907
Comenzamos calculando el trabajo, como P es constante sale fuera de la integral.
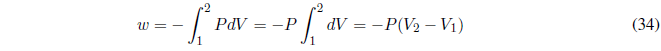
A P constante el calor intercambiado viene dado por el cambio de entalpía.
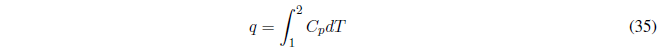
- Si \(C_p\) es independiente de la temperatura se puede sacar de la integral.
- Si nos dan como dato \(C_v\) en lugar de \(C_p\) recuérdese la relación entre ambas magnitudes, \(C_p-C_v=R\).
- El primer principio nos da el cambio de energía interna en el proceso, \(\Delta U =q+w\) .
- El cambio de entalpía coincide con el calor intercambiado.\(\Delta H =q\)
- Detalles
- Escrito por: Germán Fernández
- Categoría: Primer principio de la termodinámica
- Visto: 1882
A V constante el trabajo realizado es nulo \(w=0\).
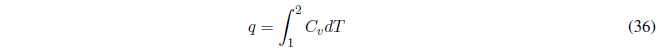
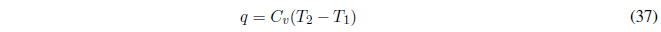
- Detalles
- Escrito por: Germán Fernández
- Categoría: Primer principio de la termodinámica
- Visto: 1913
En un proceso adiabático, las paredes del sistema impiden el intercambio de calor, por tanto, \(dq=0\;\;\rightarrow dU=dw\).
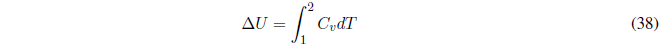
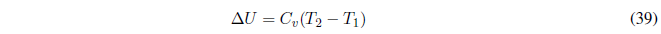
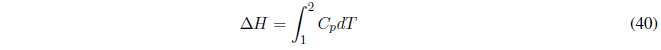
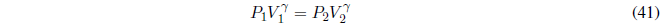
- Detalles
- Escrito por: Germán Fernández
- Categoría: Primer principio de la termodinámica
- Visto: 12539
Cuando un sistema termodinámico pasa de un estado 1 a otro 2, se dice que ha sufrido un proceso termodinámico. Se llama trayectoria o camino a los estados termodinámicos intermedios que llevan del estado 1 al 2. Dos procesos con trayectorias diferentes pueden conectar los mismos estados inicial y final.
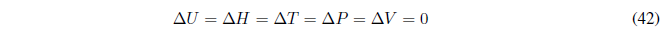
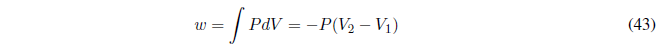
(c) Calentamiento a presión constante sin cambio de fase, comenzamos calculando el trabajo, . El calor intercambiado coincide con el cambio de entalpía que puede obtenerse a partir de la siguiente ecuación: