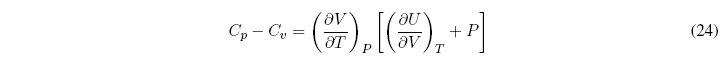La capacidad calorífica de un sistema cerrado en un proceso infinitesimal se define como el cociente entre el calor intercambiado y el cambio de temperatura producido.
Para un proceso a P=cte la capacidad calorífica viene dada por la ecuación: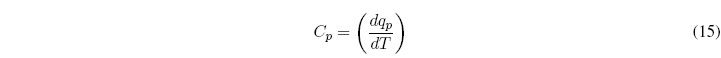
De igual manera se define la capacidad calorífica a volumen constante: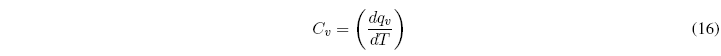
Como ![]() , las ecuaciones anteriores pueden escribirse como:
, las ecuaciones anteriores pueden escribirse como: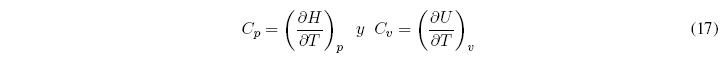
Por tanto, Cp y Cv nos dan la variación de U y H con respecto a la temperatura y siempre deben tomar valores positivos.
Definimos las capacidades caloríficas molares para sustancias puras como el cociente entre la Cp y el número de moles de la sustancia.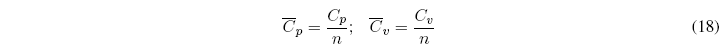
¿Qué relación existe entre Cp y Cv?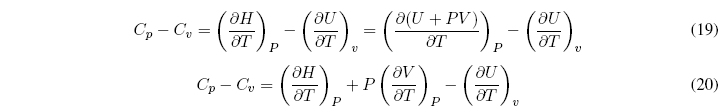
Para simplificar esta ecuación consideramos la energía interna como función de la temperatura y el volumen ![]() , y hallamos la diferencial
, y hallamos la diferencial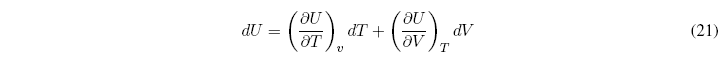
Dividiendo todos los términos por dT a P = cte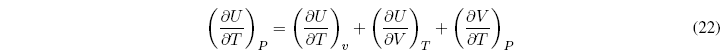
Sustituyendo en la relación Cp - Cv nos queda: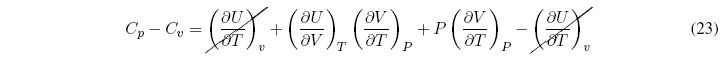
Sacando factor común a la derivada de V respecto a T nos da: