Introduccion a la Termodinámica
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 3295
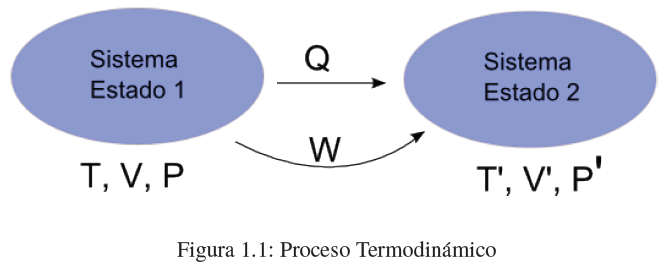
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 5194
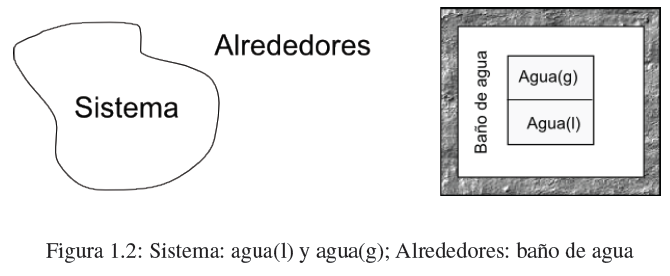
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 21305
Las paredes de un sistema se pueden clasificar en: rígidas o móviles, permeables o impermeables, conductoras o adiabáticas. Las paredes móviles se deforman permitiendo el cambio del volumen del sistema. La paredes permeables permiten el paso de materia a través de la pared. Las paredes conductoras permiten el paso de calor, mientras que las adiabáticas no (son equivalentes a las paredes de un termo).
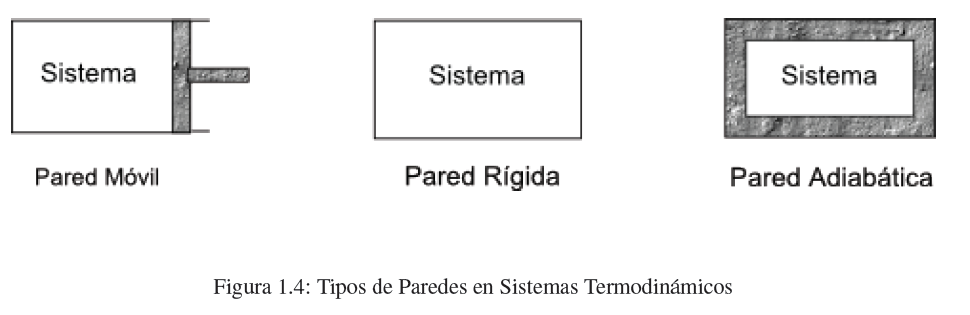
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 4382
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 4260
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 5720
Cuando un sistema no es homogéneo consta de una serie de partes con diferentes propiedades llamadas fases. Un ejemplo de sistema heterogéneo es la disolución de NaCl en agua que e encuentra en equilibrio con NaCl sólido. Este sistema presenta dos fases, la acuosa y la sólida.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 2884
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 6234
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 2323
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 2713
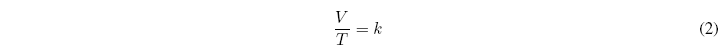
Para una masa dada de gas y a presión constante se cumple que el cociente del volumen que ocupa un gas y la temperatura a la que se encuentra es constante. Esta ley da resultados bastante exactos en condiciones de presión baja.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 2656
La ley de Boyle se aplica a procesos que mantiene la temperatura y la masa de gas constantes, por otro lado, la ley de Charles mantiene la presión y la masa de gas constante. Consideremos ahora un proceso en el que cambie la presión el volumen y la temperatura.![]()
Vamos a dividir el proceso en dos etapas, en la primera se mantiene constante la temperatura y en el segundo la presión.
Apliquemos la ley de Boyle a la primera etapa:![]()
Ahora aplicaremos la ley de Charles a la segunda etapa: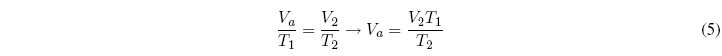
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 2956
En 1810 Dalton estableció que la presión total de una mezcla de gases es igual a la suma de las presiones que ejercería cada gas si estuviera sólo en el recipiente.
Ley de Dalton: " La suma de las presiones parciales de cada gas es igual a la presión total de la mezcla de gases".
Sea una mezcla de $n_1, n_2....$ moles de gases. Se puede calcular la presión total con la ecuación: 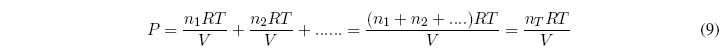
Otra forma de expresar la ley de Dalton, de gran utilidad en la resolución de problemas es: $P_i =x_iP$ , donde $P_i$ es la presión parcial del gas i, $x_i$ es la fracción molar del gas i en la mezcla de gases y P es la presión total.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 3482
La relación entre las variables de estado de un sistema (P, V, T, n) viene dada por una ecuación llamada ecuación de estado.
Como ejemplo tenemos la ecuación de estado del gas ideal PV=nRT. Sólo un gas ideal cumple esta ecuación de estado y como puede observarse relaciona las variables de estado, de modo que conocidas tres de ellas se puede obtener la cuarta.
Podemos preguntarnos que ocurre con los gases reales, ¿existen ecuaciones de estado para ellos?. La respuesta es si, una de las ecuaciones más conocidas aplicables a gases reales es la ecuación de van der Waals que tiene la siguiente forma: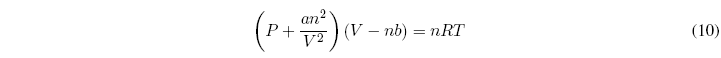
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 1996
En termodinámica es necesario utilizar algunas herramientas matemáticas como puede ser la derivada. En este vídeo explico la definición de derivada y la aplico a la función $y=x^2$. En la parte final definimos la derivada parcial de una función.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la termodinámica
- Visto: 1719
En el siguiente vídeo se halla la derivada de una función compuesta aplicando la regla de la cadena. Se calcula la diferencial total de una función de dos variables y se obtienen algunas relaciones útiles a partir de ella, como son la derivada inversa y la regla del -1.



