Boyle en 1662 encontró una relación entre la presión de un gas y el volumen que ocupa. Para una cantidad fija de gas a temperatura constante, observó que el producto de la presión por el volumen se mantenía constante:
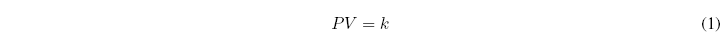
Si representamos gráficamente el producto PV frente a la P se observa que la ley de Boyle sólo se cumple a presiones bajas (la curva es horizontal). A presiones elevadas la desviación respecto a Boyle son muy importantes.
Por tanto, la ley de Boyle se cumple para gases que se comporten idealmente (condiciones de presión baja).



