Introducción a la espectroscopía
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la espectroscopía
- Visto: 3730
La espectroscopía proporciona la mayor parte de la información sobre los niveles energéticos en átomos y moléculas. Esta información se obtiene mediante el estudio de la absorción y emisión de radiación electromagnética por parte de la materia.
En este capítulo estudiaremos los espectros rotacional y vibracional de moléculas diatómicas y poliatómicas, espectros electrónicos y espectros de resonancia magnética nuclear.
La espectroscopía tiene aplicación en todos los campos de la química:
- Permite la determinación de ángulos, longitudes de enlace, conformaciones y frecuencias de vibración en moléculas.
- La química orgánica emplea la espectroscopía de resonancia magnética para determinar la estructura de compuestos orgánicos.
- En cinética se emplean métodos espectroscópicos con el objetivo de conocer la variación de un reactivo o producto en el tiempo.
- La química analítica emple la espectroscopía para determinar la composición de una muestra.
- Incluso es posible conocer la composición de planetas y estrellas lejanas estudiando la luz que nos llega.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la espectroscopía
- Visto: 2121
Las ondas electromagnéticas están formadas por campos eléctricos y magnéticos que oscilan perpendiculares entre sí y perpediculares a la dirección de propagación de la onda. La radiación electromagnética se propaga a la velocidad de \(2,998\times 10^8\;m/s\), coincidente con la velocidad de la luz.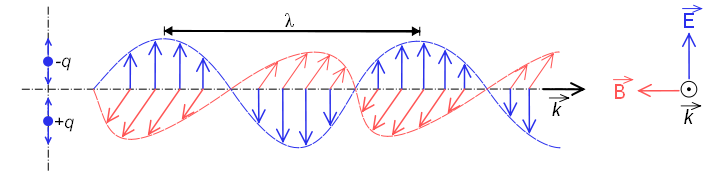
En esta figura puede verse una onda electromagnética polarizada en el plano (los vectores del campo electrico están contenidos en el mismo plano). Este tipo de onda es producida por la oscilación de una carga electrica moviéndose en un hilo recto. La radiación emitida por átomos o moléculas al ser calentados no presenta polarización, debido al movimiento aleatorio que presentan.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la espectroscopía
- Visto: 2958
Se denomina espectro electromagnético a la distribución energética del conjunto de las ondas electromagnéticas.
El espectro electromagnético se extiende desde la radiación de menor longitud de onda, como los rayos gamma y los rayos X, pasando por la luz ultravioleta, la luz visible y los rayos infrarrojos, hasta las ondas electromagnéticas de mayor longitud de onda, como son las ondas de radio. Se cree que el límite para la longitud de onda más pequeña posible es la longitud de Planck mientras que el límite máximo sería el tamaño del Universo.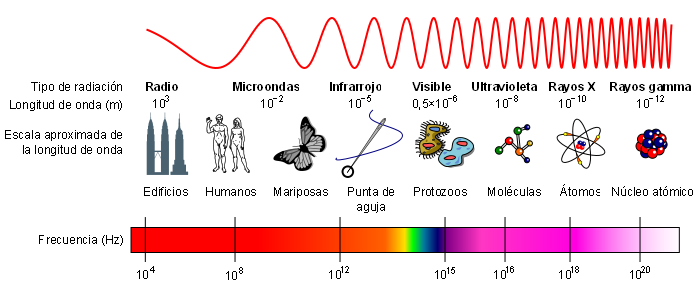
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la espectroscopía
- Visto: 2627
Independientemente de su frecuencia cualquier radiación electromagnética (luz) viaja a \(c=3\times 10^8\; m/s\) en el vacío. Sin embargo, la velocidad de la luz disminuye a un valor \(c_B\) al propagarse por un medio material homogeneo. Se define el índice de refacción \(n_B\) como el cociente entre ambas velocidades: ![]()
En la tabla siguiente se muestan valores del indice de refracción para diferentes sustancias. Se emplea como radiación la línea D del sodio (589,3 nm) a 25ºC y 1 atm.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la espectroscopía
- Visto: 2499
Cuando un haz luminoso atraviesa un prisma de vidrio, las distintas radiaciones monocromáticas son tanto más desviadas por la refracción cuanto menor es su longitud de onda. De esta manera, los rayos rojos son menos desviados que los violáceos y el haz primitivo de luz blanca se convierte en un espectro electromagnético. Un ejemplo es la dispersión de la luz blanca procedente del sol en los colores rojo, naranja amarillo, verde, azul y violeta.

Interacción Radiación-Materia según la Mecánica Cuántica
En 1905 Einstein propuso que la luz estaba formada por partículas, llamadas fotones, con energía $h\nu$. Los fotones son absorbidos o emitidos por la materia produciendo transiciones entre diferentes niveles de energía permitidos.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la espectroscopía
- Visto: 2059
La espectroscopía estudia la emisión o absorción de radiación electromagnética por parte de la materia. La espectroscopía también estudia la dispersión de la luz y la rotación del plano de polarización que producen las sustancias ópticamente activas.
Tipos de Espectros
Se llama espectro de absorción a la serie de frecuencias absorbidas por una muestra. Se denomina espectro de emisión a la serie de frecuencias emitidas por una muestra. Los espectros también se pueden clasificar en:
- Espectros de líneas, están constituidos por frecuencias discretas que aparecen en forma de bandas. Estos espectros se obtienen al calentar un gas que no se encuentre a muy alta presión.

- Espectros continuos, están formados por un intervalo continuo de frecuencias. Los sólidos y los líquidos al ser calentados suelen dar lugar a espectros continuos.

- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la espectroscopía
- Visto: 2120
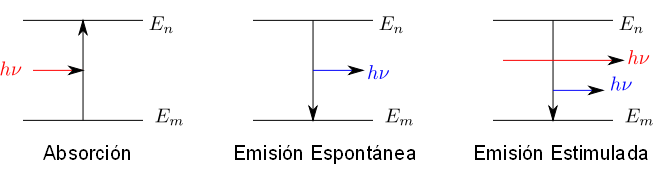
Los espectros de absorción se producen cuando la materia absorbe un fotón de frecuencia $\nu$ cuya energía es $h\nu$ y pasa de un estado de energía inferior $E_m$ a otro de energía superior $E_n$. Debe cumplirse que la diferencia de energía entre estos estados sea igual a la energía del fotón absorbido, $E_n - E_m = h\nu$.
En los espectros de emisión espontánea una molécula pasa de un estado de energía $E_n$ a otro inferior $E_m$, emitiendo un fotón de energía $E_n - E_m =h\nu$
La emisión de radiación por parte de la materia se puede favorecer por exposición a la radiación electromagnética. En este caso se habla de emisión estimulada. Exponiendo la molécula a radiación electromagnética de frecuencia $E_n - E_m =h\nu$ aumenta la probabilidad de que ocurra la transición desde el estando n al m.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Introducción a la espectroscopía
- Visto: 3260
Se puede demostrar que la probabilidad de absorción o emisión entre dos estados estacionarios m y n es proporcional al cuadrado de la integral $\mu_{mn}$ llamada momento de transición dipolar.
\begin{equation} \mu_{mn}=\int{\psi^{\ast}_m\hat{\mu}\psi_n}dq \end{equation}
Siendo $\hat{\mu}$ el momento dipolar eléctrico, definido como: $\hat{\mu}=\sum_{i}Q_ir_i$
- Cuando $\mu_{mn}=0$, la transición entre los estados m y n tiene una probabilidad nula, transición prohibida.
- Cuando $\mu_{mn}\neq 0$, la transición entre los estados m y n está permitida.



