Simetría molecular
- Detalles
- Escrito por: Germán Fernández
- Categoría: Simetria molecular
- Visto: 2017
La simetría tiene gran importancia tanto a nivel molecular como de sistemas cristalinos. A nivel molecular, la simetría, permite estudiar la espectroscopía infrarroja y describir el enlace químico entre los átomos que forman una molécula. En esta sección estudiaremos los elementos de simetría, las operaciones de simetría, los grupos puntuales, las tablas de caracteres y aplicaremos estos conocimientos a la obtención de los modos vibracionales de una molécula.
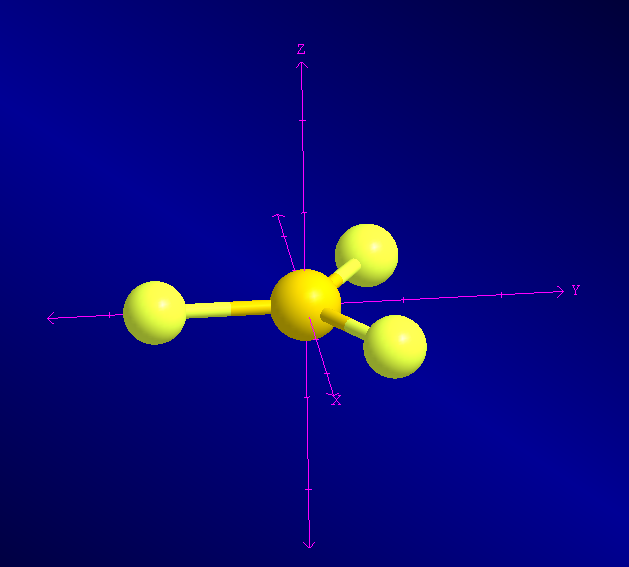
En el margen derecho puede observarse el modelo molecular del trifluoruro de boro (BF3), en el que pueden apreciarse los ejes de simetría Z e Y. La rotación de 120º en torno al eje Z deja la molécula indistinguible. En el caso del eje Y se requiere un giro de 180º.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Simetria molecular
- Visto: 1994
Una operación de simetría es aquella que aplicada a un objeto lo deja en una configuración indistinguible de la original. Las operaciones de simetría pueden ser rotaciones alrededor de ejes, reflexiones en planos, inversión respecto a un determinado punto, rotaciones seguidas de reflexiones, ect.
Los ejes, planos o puntos en relación a los cuales se realiza una operación de simetría se denominan elementos de simetría.
El BF3 presenta un eje de simetría (elemento de simetría) que deja a la molécula indistinguible por rotación de 120º (operación de simetría).
- Detalles
- Escrito por: Germán Fernández
- Categoría: Simetria molecular
- Visto: 1988
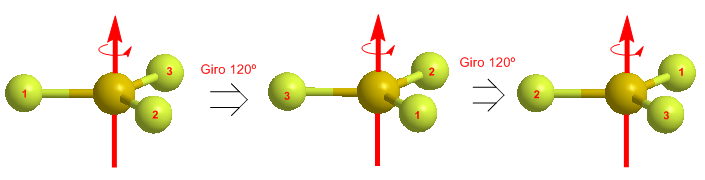
La rotación de una molécula alrededor de un eje de simetría la deja indistiguible. El eje respresenta el elemento de simetría, mientras que la rotación en torno a él es la operación de simetría. Los ejes de simetría se denotan por Cn, siendo 360º/n el ángulo de giro. Así, un eje C2 deja la molécula indistinguible cuando realizamos rotaciones de 180º; un eje C3 la deja indistinguible para rotaciones de 120º; C4 para 90º y así sucesivamente.
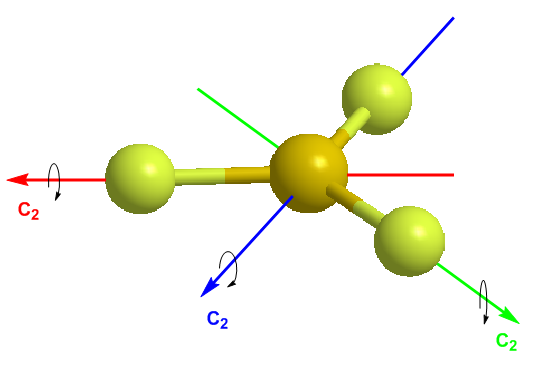
En el siguiente modelo molecular podemos observar los tres ejes propios C2 del BF3 coincidentes con los enlaces Boro-Flúor. La rotación de 180º alrededor de estos ejes deja la molécula indistinguible.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Simetria molecular
- Visto: 1988
Un plano de simetría produce la reflexión de las diferentes partes de una molécula dejándola indistinguible. Por tanto, la operación de simetría es la reflexión y el plano es el elemento de simetría.
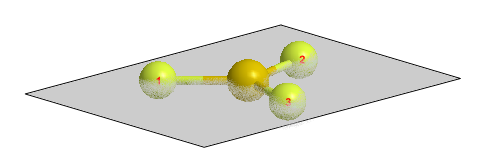
En el caso del trifluoruro de boro nos encontramos con un plano perpendicular al eje principal de la molécula (C3), denominado $\sigma_h$ y tres planos coincidentes con los ejes C2, llamados $\sigma_v$.
En el siguiente modelo podemos apreciar el plano de simetría $\sigma_h$ que parte horizontalmente la molécula reflejando la mitad inferior en la superior y viceversa.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Simetria molecular
- Visto: 3725
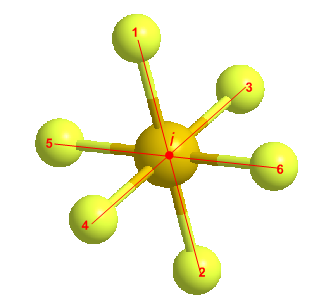
El centro de inversión (centro de simetría) es un elemento de simetría, consistente en un punto que inverte todos los átomos de la molécula, dejándola en una configuración indistinguible. El centro de inversión se designa con el símbolo i.
Veamos el centro de simetría que presenta la molécula de hexafluoruro de azufre. El SF6 tiene geometría octaédrica y todo átomo tiene su simétrico respecto a un punto (centro de inversión) situado en el centro del átomo de azufre.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Simetria molecular
- Visto: 2920
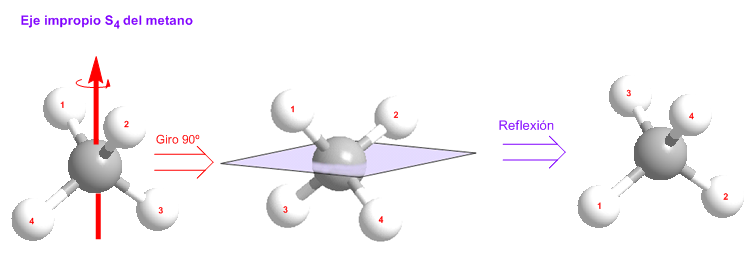
Esta operación de simetría consiste en la rotación de 360º/n alrededor de un eje, seguida de reflexión en un plano perpendicular a dicho eje, dejando a la molécula indistinguible. El elemento de simetría es un eje de rotación-reflexión, denotado por Sn y denominado eje de rotación impropio de orden n.
La molécula de metano posee tres ejes impropios de orden 4 (S4), uno de los cuales podemos ver representado en los modelos moleculares que siguen.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Simetria molecular
- Visto: 1465
Al aplicar el operador identidad a una molécula la deja inalterada. Una rotación de 360º, tres rotaciones sucesivas en torno a ejes propios C3 o cuatro rotaciones sucesivas en torno a ejes C4 son equivalentes a la operación identidad.
$E=C_3^3$ o $E=C_4^4$, en general $E=C_n^n$
- Detalles
- Escrito por: Germán Fernández
- Categoría: Simetria molecular
- Visto: 2197
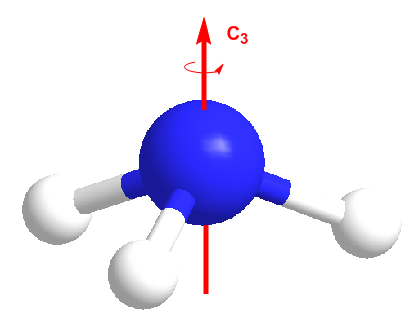
El amonicaco presenta un eje propio de simetría C3, que deja la molécula inalterada por rotaciones de 120º. Además presenta tres planos de simetría coincidentes con el eje principal, llamados $\sigma_v$. Cada uno de estos planos es coincidente con uno de los enlaces N-H bisectando los otros dos.
Modelo en el que se representa el eje propio de simetría del amoniaco
Lee más: Ejercicio 1| Obtener elementos de simetría del amoniaco
- Detalles
- Escrito por: Germán Fernández
- Categoría: Simetria molecular
- Visto: 1877
La propanona presenta tres elementos de simetría: un eje propio de segundo orden (C2) y dos planos de simetría coincidentes con el eje, llamados $\sigma_v$.
En los siguientes modelos moleculares puden observarse estos tres elementos de simetría.
1. Eje C2, deja la molécula indistinguible por rotación de 180º.
Lee más: Ejercicio 2 | Obtener elementos de simetría de la propanona (acetona)
- Detalles
- Escrito por: Germán Fernández
- Categoría: Simetria molecular
- Visto: 1784
El clorometano presenta un eje propio de simetría de orden C3 y tres planos de simetría que lo contienen.
1. Eje C3
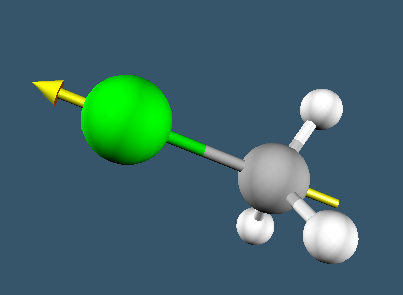
Lee más: Ejercicio 3 | Obtener elementos de simetría del clorometano



