أساسيات الكيمياء
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 4024

- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 728
 المادة هي كل ما لديه كتلة ويشغل مكانًا. الكتلة هي قياس كمية المادة التي يمتلكها الجسم. القوة المطلوبة لتسارع جسم تزيد مع كتلته (القانون الثاني لنيوتن).
المادة هي كل ما لديه كتلة ويشغل مكانًا. الكتلة هي قياس كمية المادة التي يمتلكها الجسم. القوة المطلوبة لتسارع جسم تزيد مع كتلته (القانون الثاني لنيوتن).- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 1210
 في كل عملية فيزيائية أو كيميائية، لا يحدث تغيير في كمية المادة. فيما يتعلق بتفاعل كيميائي، يجب أن يكون مجموع كتل المواد الابتدائية متساويًا لمجموع كتل المنتجات.
في كل عملية فيزيائية أو كيميائية، لا يحدث تغيير في كمية المادة. فيما يتعلق بتفاعل كيميائي، يجب أن يكون مجموع كتل المواد الابتدائية متساويًا لمجموع كتل المنتجات.- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 1355
 بيان مبدأ حفظ الطاقة: "لا يمكن إنشاء الطاقة ولا يمكن تدميرها في تفاعل كيميائي أو عملية فيزيائية. يمكن فقط تحويلها من شكل إلى آخر"
بيان مبدأ حفظ الطاقة: "لا يمكن إنشاء الطاقة ولا يمكن تدميرها في تفاعل كيميائي أو عملية فيزيائية. يمكن فقط تحويلها من شكل إلى آخر"مبدأ حفظ الطاقة، المعروف أيضًا باسم القانون الأول للديناميات الحرارية، ينص على أن الطاقة الإجمالية لنظام معزول تظل ثابتة إذا لم يكن هناك نقل للطاقة إلى أو من النظام على شكل عمل أو حرارة. بمعنى آخر، لا يمكن إنشاء الطاقة ولا يمكن تدميرها، بل يمكن فقط تحويلها من شكل إلى آخر.
رياضيًا، يُعبِّر مبدأ حفظ الطاقة عندما يُقال:
طاقة النظام الكلية = طاقة الحركة + الطاقة الكامنة + الطاقة الداخلية
تأخذ هذه المعادلة في اعتبارها مختلف أشكال الطاقة، مثل الطاقة الحركية المرتبطة بالحركة، والطاقة الكامنة المتعلقة بالموقف في مجال القوى (مثل الجاذبية)، والطاقة الداخلية التي تمثل الطاقة المرتبطة بحركة الجزيئات على مستوى الجزيئات.
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 1175
قانون الحفاظ على المادة والطاقة: أساسيات الفيزياء والكيمياء
قانون الحفاظ على المادة والطاقة هما مبدأان أساسيان يحكمان سلوك الطبيعة على مستويات صغيرة وكبيرة. كلا القانونين أساسيان في الفيزياء والكيمياء، ويوفران أساساً نظرياً لفهم مجموعة واسعة من الظواهر والعمليات في الكون.
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 1225
 يمكن تصنيف المادة إلى ثلاث حالات متميزة بوضوح.
يمكن تصنيف المادة إلى ثلاث حالات متميزة بوضوح. المادة، الجوهر الأساسي الذي يشكل كل ما حولنا، توجد في حالات متعددة، كل منها يتميز بخصائص فريدة وسلوكيات مميزة. في هذا المقال، سننطلق في رحلة مثيرة عبر حالات المادة، استكشاف الصلب، والسائل، والغاز، وفهم خصائصها، وتغييرات الحالة وتطبيقاتها في الحياة اليومية.
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 6003
في عالم الكيمياء والفيزياء المثير، تُصنف خصائص المادة إلى فئتين رئيسيتين: الخصائص الفيزيائية والكيميائية. تقدم هذه الخصائص رؤية عميقة حول كيفية تفاعل وتصرف المادة في ظروف متنوعة. سنقوم باستكشاف هاتين الفئتين وفهم أهميتهما في دراسة المادة.
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 14507
 التغيير الكيميائي هو عملية يتفاعل فيها واحدة أو أكثر من المواد لتكوين مركبات جديدة، ذات خصائص كيميائية مختلفة عن المواد الابتدائية. العمليات الكيميائية تتضمن تبادلات للطاقة.
التغيير الكيميائي هو عملية يتفاعل فيها واحدة أو أكثر من المواد لتكوين مركبات جديدة، ذات خصائص كيميائية مختلفة عن المواد الابتدائية. العمليات الكيميائية تتضمن تبادلات للطاقة.في دراسة المادة، التغييرات الفيزيائية والكيميائية هي مفاهيم أساسية تصف التحولات التي قد تخضع لها المواد. هذه التغييرات ضرورية لفهم طبيعة المادة وسلوكها في ظروف متنوعة. دعونا نستكشف الفروق بين التغييرات الفيزيائية والكيميائية، وأمثلتها، وأهميتها في العلم.
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 601

المزج هو مزيج من المواد النقية. كل مادة تحتفظ بخصائصها الفيزيائية والكيميائية في المزيج. على سبيل المثال، إذا صبنا 50 مل من الميثانول و 50 مل من الماء في كوب، فإننا نحصل على مزيج، حيث يحتفظ كل من الميثانول والماء بخصائصه.
عندما لا تتغير خصائص المزيج من نقطة إلى نقطة، يُطلق عليها اسم متجانس. في المزج غير المتجانس، تتغير الخصائص بمرور الوقت أثناء التحرك في المحلول. مثال على ذلك هو المزيج الإيثانول-الماء الذي يعد متجانسًا، والهواء الذي يتألف من النيتروجين والأكسجين وثاني أكسيد الكربون وبخار الماء هو مثال آخر على مزيج متجانس.
مزيج الملح العادي وسكروز (سكر الطعام) الصلب هو غير متجانس. أثناء التحرك في المزيج، نجد في بعض النقاط سكروزًا وفي الآخر ملحًا.
يمكن فصل المواد التي تشكل مزيجًا باستخدام طرق فيزيائية، مثل التقطير، والاستخراج، والبلورة، والطرق التي تعتمد على الخصائص المغناطيسية للمواد، وما إلى ذلك.
لذا، يمكن فصل مزيج غير متجانس من الحديد والكبريت باستخدام المغناطيس، باستناد إلى الخصائص المغناطيسية للحديد. والنتيجة هي الحصول على مواد نقية، حديد نقي وكبريت نقي.
يمكن فصل مزيج الماء والميثانول الذي يعد متجانسًا باستناد إلى نقاط الغليان المختلفة لكل من المكونين. هذه التقنية المستخدمة للفصل تُعرف باسم التقطير. النتيجة هي الحصول على المواد اللتين تشكلان المزيج مفصولتين.
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 686

تقوم الكيمياء على الملاحظة والتجربة، حيث نحاول الحصول على سلسلة من النتائج التي في كثير من الحالات يمكن التعبير عنها بشكل رقمي، مما يسمح بمقارنتها مع النتائج المستخلصة من تجارب أخرى.
في كل مراقبة وتجربة، نركز على تلك الخصائص التي يمكن مقارنتها وبالتالي يمكننا قياسها. هذه الخصائص تسمى القياسات.
هناك مجموعة صغيرة من القياسات، تسمى القياسات الأساسية، يمكن من خلالها الحصول على كل القياسات الأخرى. هذه القياسات هي: الطول، الكتلة، الزمن، كثافة التيار، درجة الحرارة، كمية المادة، وكثافة الإضاءة.
يخصص النظام الدولي للوحدات وحدة لكل قياس. المتر هو وحدة الطول. إذا كنت قد قست مسافة وحصلت على 20 مترًا، فهذا يعني أن الطول هو 20 مرة وحدة النظام الدولي.
تعريف الوحدات الأساسية في النظام الدولي، وفقًا للقرارات المتعلقة الصادرة عن مؤتمر الأوزان والمقاييس العام (CGMP)، هي كالتالي:
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 612
في التدوين العلمي، يتم تعبير الرقم 0.000005 على أنه 5 × 10-6.
التدوين العلمي: تبسيط الأعداد على مقياس الكون والميكروسكوبي
التدوين العلمي هو وسيلة فعالة للتعبير عن الأعداد الكبيرة جدًا أو الصغيرة جدًا باستخدام أسس العشرة. يسهل هذا التدوين كتابة وتلاعب الأرقام التي، في حالة أخرى، قد تكون مُحيرة. فهم كيفية استخدام التدوين العلمي أمر أساسي في مجالات متنوعة، من العلوم والهندسة إلى علم الفلك والفيزياء. سنستكشف المبادئ الأساسية للتدوين العلمي وكيفية تطبيقه.
المبادئ الأساسية للتدوين العلمي
1. التنسيق العام:
يُمثل التدوين العلمي على أنه a×10n، حيث a هو عدد أكبر من أو يساوي 1 وأقل من 10 (المعامل)، و n هو مرفوع العدد الصحيح.
2. التعبير عن الأعداد الكبيرة:
للتعبير عن الأعداد الكبيرة، يُستخدم مرفوع موجب. على سبيل المثال، يُعبر عن الرقم 450,000,000 بـ 4.5×108.
3. التعبير عن الأعداد الصغيرة:
للتعبير عن الأعداد الصغيرة، يُستخدم مرفوع سالب. على سبيل المثال، يُعبر عن الرقم 0.0000023 بـ 2.3×10−6.
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 453
النتائج المستخلصة في القياس ليست دقيقة. كل قياس يتضمن تقديرًا. على سبيل المثال، لنفترض أننا بحاجة إلى قياس جسم باستخدام مسطرة مقسمة بالميليمتر. عندما نقوم بالقياس، نحصل على نتيجة تتراوح بين 38 و 39 ملم، ونقدر أن حجم الجسم هو 38.5 ملم. تحتوي هذه النتيجة على جزء دقيق 38 وجزء مقدر (تقريبي) وهو الرقم 5 الأخير. الرقم 38.5 ملم يحتوي على ثلاثة أرقام معنوية. الرقم الأخير مشكوك فيه، ولكن يُعتبر رقمًا معنويًا. عند إعطاء نتيجة قياس، ندرج رقمًا تقريبيًا، ولكن فقط واحدًا.
سنستخدم بروفيت لقياس حجوم السوائل. على يمين البروفيت، يتم تكبير خطوط المعايرة. على مقياس اليمين، نتحرك من 10 مل إلى 10 مل. المقياس على اليسار مقسم بحيث يتغير من مل إلى مل.
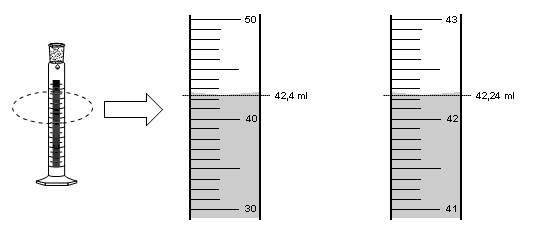
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 397
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 1395
لنفترض أن 8.56 هو نتيجة عملية تمت باستخدام الآلة الحاسبة. إذا كان عدد الأرقام المعنية هو اثنان فقط، يجب أن نقدم النتيجة كـ 8.5. ولكن نظرًا لأن الرقم الثالث أكبر من 5، يتم تقريب الرقم الثاني إلى 6. النتيجة النهائية هي 8.6.
عندما يكون الرقم الذي يتم إزالته أقل من 5، لا يتغير الرقم الذي يسبقه. في حال كان الرقم 5 هو الذي يتم إزالته، يتم استبدال الرقم الذي يسبقه بالرقم الزوج الأقرب.
لنرى أمثلة:
8.48 يتم تقريبها إلى 8.5؛ 2.43 يتم تقريبها إلى 2.4؛ 2.45 يتم تقريبها إلى 2.4؛ 2.35 يتم تقريبها إلى 2.4.
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 571
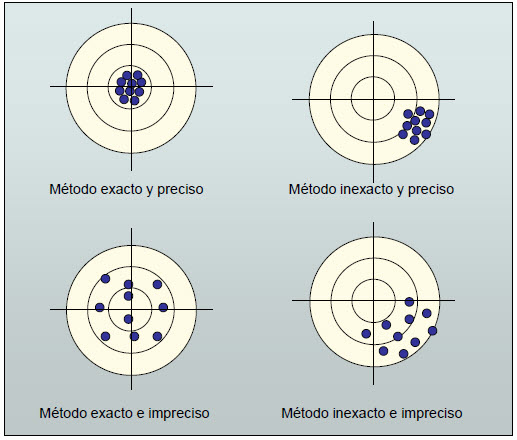
الدقة تعطينا درجة التطابق بين القيمة المقاسة والقيمة الحقيقية.
الدقة متعلقة بتكرار القياسات. تشير إلى درجة التوافق بين عدة قياسات فردية.
يمكن أن تكون الميزان دقيقة للغاية إذا كانت تظهر نفس النتيجة في عدة قياسات. ومع ذلك، فإنها غير دقيقة إذا كانت هذه النتيجة لا تتفق مع الواقع. لذلك يجب أن يُطلب من أدوات القياس أن تكون دقيقة ودقيقة في نفس الوقت.
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 300
تعتمد عوامل التحويل على الضرب في كسور يكون لديها في البسط والمقام نفس الكمية ولكن في وحدات مختلفة. بعض أمثلة على عوامل الوحدة هي كالتالي: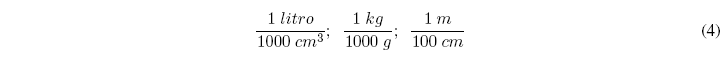
في عوامل التحويل، توجهنا الوحدات في الحسابات. يتم إلغاء جميع الوحدات حتى نصل إلى النتيجة المطلوبة.
لنرى تطبيقًا لعوامل التحويل: علمًا بأن إرغي يعادل 1 × 10-7 جول. تحويل 3.74 × 10-2 إرغي إلى جول.
يمكن الحصول على الحلا عن طريق تطبيق عوامل التحويل: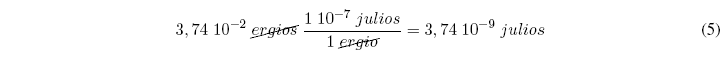
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 1582
تعرف الكثافة بأنها الكتلة لكل وحدة من الحجم. يمكن الحصول على الكثافة عن طريق قسمة كتلة العينة على حجمها.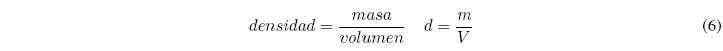
الوحدات الأكثر استخدامًا هي g/cm3، g/ml وأيضًا g/l. نظرًا لأن كل مادة لديها كثافة فريدة، يمكن استخدام هذه البيانات لتحديد العناصر.
ترتبط الكثافة النسبية بكثافة المادة بكثافة الماء، كلها عند نفس درجة الحرارة.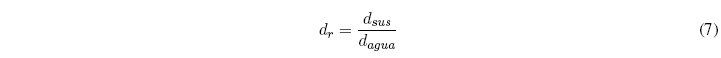
حتى 25 درجة مئوية يمكننا اعتبار كثافة الماء 1 جم/مل. لذلك، عند درجة الحرارة الغرفية، تتطابق كثافة المادة مع الكثافة النسبية. عند درجات حرارة أعلى، تختلف كثافة الماء عن 1 جم/مل وتتوقف الكثافتان عن التطابق.
- التفاصيل
- كتب بواسطة: Germán Fernández
- المجموعة: أساسيات الكيمياء
- الزيارات: 468
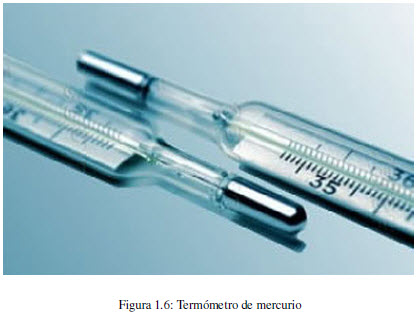 الحرارة هي نوع من أنواع نقل الطاقة، والتي تحدث نتيجة لفارق في درجات الحرارة. تتم نقل الحرارة دائمًا من الجسم الساخن إلى الجسم البارد.
الحرارة هي نوع من أنواع نقل الطاقة، والتي تحدث نتيجة لفارق في درجات الحرارة. تتم نقل الحرارة دائمًا من الجسم الساخن إلى الجسم البارد.
يمكن قياس درجة حرارة جسم ما باستخدام ميزان حراري يحتوي على مستودع للزئبق متصل بشعيرة رفيعة. عند تسخين المستودع، يتمدد الزئبق في الشعيرة. يظهر ارتفاع زئبق أكبر عند درجة حرارة أعلى.
لقياس درجات الحرارة، يتعين أن يتوفر معنا مقياس لدرجات الحرارة. قام عالم الفلك السويدي أندرس سيلسيوس بتطوير ما يُعرف بمقياس سيلسيوس لدرجات الحرارة. يتخذ نقطة انصهار الماء، التي يُعين لها قيمة 0 درجة سيلسيوس، ونقطة غليانها عند ضغط الهواء الجوي الذي يُعين لها قيمة 100 درجة سيلسيوس. بين هذين النقطتين يوجد مئة تقسيم، وكل تقسيم يُمثل درجة سيلسيوس واحدة.
مقياس درجات الحرارة الذي يُستخدم على نطاق واسع في الولايات المتحدة هو مقياس فهرنهايت. في هذا المقياس، يتم اعتبار نقطة تجمد الماء ونقطة غليانه عند 32 درجة فهرنهايت و212 درجة فهرنهايت على التوالي.



