Las reacciones químicas
- Detalles
- Escrito por: Germán Fernández
- Categoría: Las reacciones químicas
- Visto: 1721
Las reacciones químicas son muy frecuentes en la vida cotidiana. Cuando encendemos una cocina de gas estamos realizando una reacción de combustión, en la que el gas propano o butano se combinan con el oxígeno del aire para formar dióxido de carbono y agua.
Otra reacción muy conocida es la oxidación del Hierro, su combinación con el oxígeno del aire en condiciones apropiadas genera óxido de Hierro. Esta reacción química produce pérdidas millonarias, debido al rápido deterioro de herramientas, estructuras, etc.
Existen reacciones muy espectaculares, como la que tiene lugar entre el óxido de Hierro (III) y el aluminio metal (en polvo), para producir hierro líquido y óxido de aluminio. Esta reacción desprende gran cantidad de calor, liberando productos en fase líquida. Se emplea para soldar grandes estructuras de hierro y se conoce como reacción termita.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Las reacciones químicas
- Visto: 1812
En una reacción química un conjunto de sustancias llamadas reactivos se transforman en otras llamadas productos. Una transformación química puede evidenciarse por el cambio en propiedades físicas de la disolución, como pueden ser: cambio en el color, desprendimiento o absorción de calor, formación de precipitados o desprendimiento de gases.
Para describir las reacciones químicas empleamos una notación, la ecuación química. En el lado izquierdo de la ecuación química se representan las fórmulas de los reactivos y en el lado derecho las de los productos, separadas ambas por una flecha de punta completa en el caso de reacciones irreversibles (que sólo transcurren de izquierda a derecha) o una doble flecha en el caso de reacciones reversibles (transcurren en ambos sentidos).
$$CH_4+O_2 \rightarrow CO_2 + H_2O$$
En esta ecuación química se representa la reacción de combustión del butano. El gas butano (CH4) se combina con oxígeno (O2) para generar de forma irreversible dióxido de carbono (CO2) y agua (H2O)
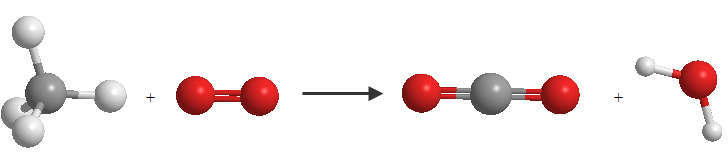
En esta ecuación observamos que hay diferente número de átomos de oxígeno e hidrógeno a ambos lados de la ecuación, lo cual requiere realizar un ajuste.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Las reacciones químicas
- Visto: 2060
En este tipo de ajuste buscamos por tanteo los coeficientes estequiométricos que ajustan la ecuación química. Para simplificar esta operación seguimos unas sencillas pautas.
- Los elementos que aparecen en un sólo reactivo y producto se ajustan primero.
- Los elementos libres se ajustan al final.
- El uso de coeficientes fraccionarios puede facilitar el ajuste. Estos coeficientes fraccionarios pueden eliminarse multiplicando toda la ecuación por el denominador común.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Las reacciones químicas
- Visto: 2822
La estequiometría nos permite conocer la relación entre las cantidades de los compuestos que participan en una reacción química. Si nos fijamos en los coeficientes estequiométricos de la ajustada para la síntesis del amoniaco, \(N_2 + 3H_2 \rightarrow 2NH_3\), podemos deducir que una molécula (o mol) de nitrógeno reacciona con tres de hidrógeno para formar dos de amoniaco.
¿Cuántos gramos de amoniaco se obtendrán a partir de 5,00 gramos de nitrógeno?
\begin{equation}\bbox[5px,border:2px solid red]{\color{red}{5,00\; g\; N_2\cdot \frac{1\;mol\; N_2}{ 28,01\;g\;N_2}\cdot \frac{2\;mol\;NH_3}{1\;mol\;N_2}\cdot\frac{17,00\;g\;NH_3}{1\;mol\;NH_3}=6,07\;g\;NH_3}}\end{equation}
Veamos como ejemplo la reacción de combusitión del hidrógeno.
\begin{equation} 2H_2(g)+O_2(g)\rightarrow H_2O(l) \end{equation}
- Detalles
- Escrito por: Jordi
- Categoría: Las reacciones químicas
- Visto: 4117
Para un químico, expresiones del tipo:
$$\displaystyle CH_4 + 2\ O_2 \longrightarrow CO_2 + 2\ H_{2}O$$
resultan intuitivas y describen el comportamiento global de las sustancias que en ellas aparecen. Esta forma de representar las reacciones químicas es simple y deriva de forma natural del empleo de las fórmulas químicas como representación escrita de las sustancias que intervienen en cualquier tipo de reacción. Un químico identifica rápidamente el nombre de la sustancia metano con su fórmula $CH_4$ y con todo lo que ambas representaciones, nombre y fórmula, significan: composición estequiométrica de la sustancia, masa molecular, tipo de compuesto químico, características físicas... etc. Años de estudio individual y el trabajo previo de muchas generaciones de investigadores esconden todo eso detrás de una simple fórmula y un nombre. Pero en muchas ocasiones, es necesario convertir este simbolismo en algo mucho más general. Los cálculos matemáticos exigen utilizar expresiones generales que puedan tratarse numéricamente y que tengan un sistema de notación, una formulación numérica, sólido y riguroso.
Consideremos un conjunto formado por $S$ compuestos químicos (se entiende que estamos hablando de sustancias puras en general, esto es, tanto compuestos en sentido estricto, por ejemplo $CH_4$, como elementos, $O_2$). Designaremos a cada compuesto con un nombre: $A_1$, $A_2$, ..., $A_i$, ..., donde $i$ $=$ $1$, $2$, ..., $S$. Según esta forma de representación, la reacción que hemos citado antes, se podría escribir:
$$\displaystyle CH_4 + 2\ O_2 \longrightarrow CO_2 + 2\ H_{2}O \quad\equiv\quad A_1 + 2\ A_2 = A_3 + 2\ A_4$$
donde, en este caso:
$$\displaystyle \begin{array}{c} S = 4\\ CH_4 \equiv A_1\\ O_2 \equiv A_2\\ CO_2 \equiv A_3\\ H_{2}O \equiv A_4 \end{array} $$
- Detalles
- Escrito por: Germán Fernández
- Categoría: Las reacciones químicas
- Visto: 2135
En este punto no limitaremos a las disoluciones acuosas, formadas por agua como disolvente y otros componentes minoritarios llamados solutos. Así, cuando escribimos KCl(ac), no referimos a una disolución acuosa que contiene KCl como soluto.
Para trabajar con estas disoluciones es conveniente introducir nuevas formas de establecer la proporción entre soluto y disolvente, además de la composición porcentual.
Molaridad: Se define como el cociente entre los moles de soluto y el volumen de la disolución. \begin{equation} Molaridad\ (M)=\frac{Moles\ soluto}{volumen\ disoluci\acute{o}n\ (litros)} \end{equation} La molaridad se representa por el símbolo M y tiene de unidades mol/L.
Una disolución 0.2 M (0.2 molar) de glucosa contiene 0.2 moles de glucosa en 1 litro de disolución.



