Enlace químico I
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 1815
Los átomos tienden a unirse formando moléculas para alcanzar configuraciones electrónicas de mayor estabilidad. Existen dos tipos fundamentales de enlaces:
- El enlace iónico resulta de transferir uno o más electrones desde el átomo menos electronegativo al más electronegativo.
- El enlace covalente resulta de compartir uno o más electrones entre los átomos que forman el enlace.
Los enlaces iónico y covalente respresentan extremos teóricos que no suelen darse en la naturaleza, los enlaces reales tienen tanto carácter iónico como covalente.
Cuando el carácter iónico predomina claramente sobre el covalente el compuesto es llamado iónico. En el caso de predominar el carácter covalente del enlace se habla de compuesto covalente. Las moléculas formadas por un sólo tipo de átomo no presentan carácter íónico, se trata de enlaces covalentes puros (N2, O2, Cl2)
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 8357
Los compuestos iónicos presentan las siguientes propiedades físicas:
- Son sólidos con elevados puntos de fusión.
- Son solubles en disolventes polares (agua). Sin embargo, presentan baja solubilidad en disolventes apolares.
- Fundidos y en disolución acuosa conducen la corriente electrica.
- Se obtienen a partir de elementos con distinta electronegatividad (metal y nometal)
Lee más: Propiedades Físicas de Compuestos Iónicos y Covalentes
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 3592
La configuración electrónica de los átomos es clave para entender cómo se forman las moléculas. Gilbert Newton Lewis llegó a la conclusión de que los átomos se combinan para alcanzar la configuración electrónica de los gases nobles.
En la formación de un enlace entre das átomos sólo participan los electrones más externos, llamados electrones de valencia. Lewis diseñó un sistema para representar el átomo con sus electrones de valencia, que consiste en dibujar el símbolo del elemento rodeado de puntos, que representan cada uno de los electrones de valencia.
Ideas principales de la teoría de Lewis:
- Los electrones de valencia son los responsables de formar enlaces.
- Los electrones pueden transferirse entre átomos dando lugar a cationes y aniones que se atraen para formar compuestos iónicos.
- Cuando los electrones se comparten entre los átomos se forman enlaces covalentes
- Los electrones intercambiados permiten a los átomos adquirir la estructura electrónica de gas noble. Generalmente quedan rodeados de 8 electrones en su capa externa, llamado octeto.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 2621
Los metales alcalinos tienden a perder un electrón para alcanzar la configuración electrónica de gas noble, transformándose en iones positivos. Por otro lado los halógenos alcanzan dicha configuración al añadir un electrón a su capa de valencia, transformándose en iones negativos. La unión de iones positivos y negativos por fuerzas electrostáticas genera una red cristalina, un compuesto iónico.
Así el fluoruro de litio (LiF) se obtiene cuando el litio (1s22s1) cede uno de los electrones de valencia al flúor (1s22s22p5), formándose el catión litio (1s2)y el anión fluoruro (1s22s22p6). Como puede observarse en las configuraciones electrónicas el catión litio es isoelectrónico al helio y el anión fluoruro isoelectrónico al neon.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 2119
Un enlace covalente se forma cuando dos átomos comparten uno o más pares de electrones. La condición para que el enlace tenga un elevado carácter covalente es que la diferencia de electronegatividad entre ambos átomos sea cero o muy pequeña. Según la teoría de Lewis el enlace que da lugar a la molécula de hidrógeno puede describirse del siguiente modo:![]()
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 6292
La energía reticular nos da una medida de la estabilidad de un compuesto iónico, y se defiene como la energía necesaria para separar completamente un mol de un compuesto iónico sólido en sus iones en estado gaseoso. Cuando los iones se unen para formar la red cristalina se desprende calor (proceso exotérmico), el compuesto iónico es más estable que los iones separados. Para romper el compuesto iónico separando los iones que lo forman es necesario dar una energía (igual a la desprendida al formarse) llamada reticular.
El ciclo de Born-Haber permite obtener la energía reticular de un compuesto iónico mediante las siguientes etapas, analizadas para la formación del LiF(s):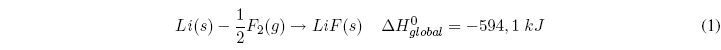
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 4154
En el siguiente vídeo se muestra cómo construír la estructura de Lewis de la urea.
- Obtener los electrones de valencia: 24
- Elegir el átomo central: carbono
- Asignar pares solitarios a los átomos terminales.
- Completar el octeto del átomo central
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 2604
En este vídeo describo los pasos para obtener la estructura de Lewis del cloruro de tionilo $(SOCl_2)$
- Cálculo de los electrones de valencia: 7x2+6+6=26
- Dibujar el esqueleto
- Completar el octeto de los átomos terminales
- Ceder pares electrónicos de átomos terminales hacia el átomo central para minimizar la carga formal
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 2695
Estructura de Lewis del dióxido de carbono, $(CO_2)$
- Electrones de valencia: 4+2x6=16
- Dibujar el esqueleto, tomando como átomo central el carbono (elemento menos electronegativo)
- Completar los octetos de los átomos terminales (oxígenos)
- Ceder pares solitarios de los oxígenos para completar el octeto del átomo central (carbono)
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 4872
En este vídeo describo los pasos a seguir para dibujar la estructura de Lewis del ion nitrito, $(NO_2^-)$
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 8009
Para escribir la estructura de Lewis del ion nitrosonio seguimos los pasos:
- Obtener los electrones de valencia: 5+6-1=10
- Dibujar el esqueleto de la molécula.
- Distribuir los electrones de valencia entre los átomos, comenzando por el oxígeno.
- Ceder pares solitarios a enlazantes para completar octetos y buscar la menor carga formal.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 2281
En el siguiente vídeo se describe la construcción de la estructura del ion triyoduro $(I_3^-)$.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 2304
En este vídeo se obtiene la estructura de Lewis del oxitrifluoruro de xenón. Además se asignan cargas formales para determinar la estructura correcta de la molécula.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 4351
En el siguiente vídeo construímos la estructura de Lewis del tetrafluoruro de xenon. Los pasos a seguir son:
- Calcular electrones de valencia: 8+7x4=36
- Escribir el esqueleto molecular con el xenon en el centro.
- Completar los octetos de los átomos terminales (flúor)
- Colocar los pares que sobran sobre el átomo central
- Asignar cargas formales y ceder pares solitarios a enlazantes en caso necesario.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 19720
En el siguiente vídeo se muestra como escribir la estructura de Lewis del ácido cianhídrico, HCN.
- Obtener los electrones de valencia 4+5+1=10
- Dibujar el esqueleto de la molécula
- Asignar electrones solitarios a los átomos terminales completando su octeto
- Ceder pares solitarios a enlazantes para completar el octeto del átomo central.
- Asignar cargas formales para ver que la estructura dibujada es la más probable.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 16298
En este vídeo comento los pasos necesarios para escribir la estructura de Lewis del ácido sulfúrico $(H_2SO_4)$:
- Calcular el número de electrones de valencia: 6x4+6+2=32
- Dibujar el esqueleto molecular.
- Completar octeto de átomos terminales.
- Cedar pares solitarios a enlazantes para buscar la estructura que minimice la carga formal de los átomos.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Enlace químico I
- Visto: 2086
En este vídeo se construyen las estructuras de Lewis del ácido carbónico, ácido fosfórico y ácido fosforoso. Debe prestarse especial atención a la peculiaridad del ácido fosforoso, que sólo presenta dos hidrógenos ácidos.



