Propiedades periódicas
- Detalles
- Escrito por: Germán Fernández
- Categoría: Propiedades periódicas
- Visto: 2038

- Detalles
- Escrito por: Germán Fernández
- Categoría: Propiedades periódicas
- Visto: 6799
Mendeleiev ordenó los elementos según masas atómicas, dejando espacios en blanco para elementos aún por descubrir. Así predijo la existencia de los elementos de masa atómicas 44, 68, 72 y 100 correspondientes a escandio, galio, germanio y tecnecio.
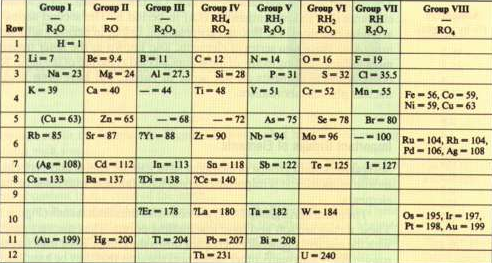
- Detalles
- Escrito por: Germán Fernández
- Categoría: Propiedades periódicas
- Visto: 3976
 Mendeleiev ordenó los elementos según masas atómicas crecientes, pero se vio obligado a modificar la posición de algunos de ellos para formar grupos con propiedades similares.
Mendeleiev ordenó los elementos según masas atómicas crecientes, pero se vio obligado a modificar la posición de algunos de ellos para formar grupos con propiedades similares. - Detalles
- Escrito por: Germán Fernández
- Categoría: Propiedades periódicas
- Visto: 4959

- Detalles
- Escrito por: Germán Fernández
- Categoría: Propiedades periódicas
- Visto: 11350
Dado que la densidad electrónica de un átomo no se hace cero nunca resulta difícil definir el tamaño de los átomos. Una posibilidad es considerar el radio de la esfera que contiene una probabilidad elevada de encontrar el electrón, por ejemplo del 90$\%$. Sin embargo, estamos más interesados en conocer el tamaño de los átomos cuando están enlazados, formando compuestos covalentes o iónicos.
Se define el radio covalente como la mitad de la distancia entre los núcleos dos átomos iguales unidos por un enlace covalente simple. El radio iónico es la distancia entre los núcleos de dos átomos unidos por un enlace iónico. En este último caso la distancia debe repartirse de forma correcta entre el catión (más pequeño) y el anión (más grande).
- Aumento del radio atómico en un grupo. Al incrementarse el valor de n se desplaza la densidad de probabilidad hacia valores más elevados de r, dando lugar a un átomo más grande. Se observa un incremento importante del radio al pasar del Li al Na y del Na al K. El aumento de radio en elementos de número atómico elevado (paso del potasio al rubidio) es menor debido a la existencia de subcapas d y f que apantallan el núcleo con menor efectividad que las s y p, haciendo que los electrones externos se encuentren más atraídos por el núcleo.
- Disminución del radio atómico en un periodo. Al movernos hacia la derecha en un periodo se produce un incremento de la carga nuclear efectiva que actúa sobre los electrones externos, comprimiendo el átomo. En el caso particular de los elementos de transición esta variación es pequeña debido a que los electrones se van metiendo en una subcapa (n-1)d interna que contribuye al apantallamiento de los electrones externos, ns.
Lee más: Radio atómico e iónico. Variación en la tabla periódica
- Detalles
- Escrito por: Germán Fernández
- Categoría: Propiedades periódicas
- Visto: 7618
La energía de ionización, I, es la energía necesaria para arrancar un electrón a un átomo gaseoso, aislado y en estado fundamental. Los electrones se encuentran atraídos por el núcleo y es necesario aportar energía para arrancarlos. Siempre se pierden los electrones de la última capa, que son los más débilmente atraídos por el núcleo. \begin{equation} Mg(g) \rightarrow Mg^{+}(g)+1e^{-} \end{equation} Esta ecuación representa la primera ionización del Mg y requiere $I_1$=738 kJ/mol.
Es posible continuar arrancando electrones al ion $Mg^+$ obteniendo el $Mg^{2+}$. Esta segunda ionización siempre requiere más energía que la primera ($I_2$=1451 kJ/mol).
- Detalles
- Escrito por: Germán Fernández
- Categoría: Propiedades periódicas
- Visto: 9019
La afinidad electrónica (AE) se define como la energía intercambiada (suele liberarse) cuando un átomo gaseoso aislado y en estado fundamental coge un electrón para formar un anión. Así el átomo de F libera 328 kJ/mol cuando captura un electrón y se transforma en $F^-$. El anión fluoruro es muy estable por tener la configuración electrónica del neon.
\begin{equation} F(g)+1e^-\rightarrow F^-(g) \end{equation}
Aunque los átomos que más energía liberan al captar un electrón se encuentran en la tabla periódica a la derecha, se observa que metales como el litio, en estado gaseoso, también liberan energía formando aniones litio.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Propiedades periódicas
- Visto: 28192
La electonegatividad se define como la capacidad de un elemento para atraer hacia sí los electrones que lo enlazan con otro elemento. Esta propiedad periódica nos permite predecir la polaridad del enlace formado entre dos átomos, así como el carácter covalente o iónico del mismo.
La electronegatividad está relacionada con la energía de ionización y la afinidad electrónica. Un átomo con una afinidad electrónica muy negativa y un potencial de ionización elevado presenta una electronegatividad alta (cloro, flúor). Por el contrario átomos con baja afinidad electrónica y bajo potencial de ionización tienen electronegatividad pequeña (alcalinos).
La electronegatividad aumenta, por tanto, hacia la derecha y hacia arriba en la tabla periódica.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Propiedades periódicas
- Visto: 2182
Un átomo o ion es diamagnético si posee todos sus electrones apareados. Las sustancias diamagnéticas son débilmente repelidas por los campos magnéticos.
Un atomo o ion es paramagnético y presenta algún electrón desapareado. Las sustacias paramagnéticas son atraídas por los campos magnéticos.



