La electonegatividad se define como la capacidad de un elemento para atraer hacia sí los electrones que lo enlazan con otro elemento. Esta propiedad periódica nos permite predecir la polaridad del enlace formado entre dos átomos, así como el carácter covalente o iónico del mismo.
La electronegatividad está relacionada con la energía de ionización y la afinidad electrónica. Un átomo con una afinidad electrónica muy negativa y un potencial de ionización elevado presenta una electronegatividad alta (cloro, flúor). Por el contrario átomos con baja afinidad electrónica y bajo potencial de ionización tienen electronegatividad pequeña (alcalinos).
La electronegatividad aumenta, por tanto, hacia la derecha y hacia arriba en la tabla periódica.
Una escala de electronegatividades muy utilizada es la creada por Linus Pauling en 1904. Los valores de la escala de Pauling oscilan entre 0.7 para el Francio y 4 para el Flúor. Utilizando la tabla de electronegatividades vamos a predecir la polaridad de algunos compuestos.
- $F_2$. La electronegatividad del flúor es 4. La diferencia de electronegatividad entre los átomos que forman el enlace es: 4-4=0. Se trata de un enlace covalente apolar.
- HF. La electronegatividad del Flúor es 4, la del hidrógeno 2.1. La diferencia de electronegatividad entre ambos átomos es: 4-2.1=1.9. Se trata de un enlace covalente polar.
- LiF. La electronegatividad del Flúor es 4, la del litio 1. La diferencia de electronegatividades: 4-1=3. Se trata de un enlace de tal polaridad que lo denominamos iónico. En este enlace el flúor retiene los electrones del enlace y se encuentra en forma de anión fluoruro, el litio por su parte está como catión litio.
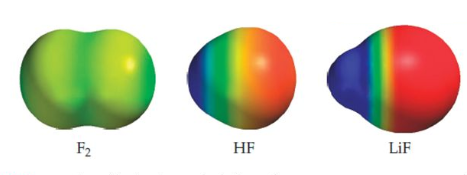
En esta imagen podemos observar las densidades electrónicas en las moléculas de $F_2$, HF y LiF. La región azul es pobre en densidad electrónica, mientras que la roja es rica.
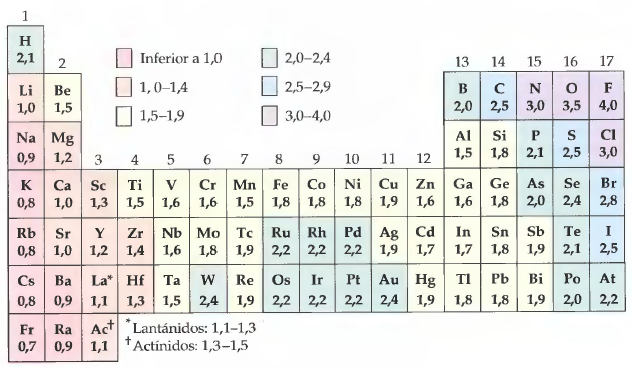
Tabla de electronegatividades de Pauling.
Vídeo:



