Los compuestos químicos
- Detalles
- Escrito por: Germán Fernández
- Categoría: Los compuestos químicos
- Visto: 2092
Los elementos químicos están formados por un sólo tipo de átomo (Na, K, O2, N2), mientras que los compuestos se forman por unión de dos o más tipos de átomos.
El agua es un compuesto químico formado por dos átomos de hidrógeno y uno de oxígeno (H2O).
El dióxido de carbono está formado por un átomo de carbono y dos de oxígeno (CO2).
Los compuestos químicos se representan mediante los símbolos de los elementos que los forman acompañados de subíndices que indican la proporción en que participan dichos elementos.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Los compuestos químicos
- Visto: 17836
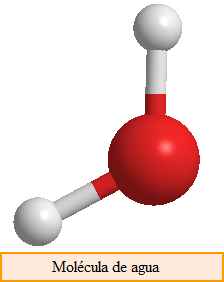 Los enlaces que unen los diferentes átomos que forman un compuesto químico pueden ser iónicos o covalentes. En los enlaces covalentes se comparten electrones, mientras que el enlace iónico supone la cesión de electrones entre átomos. Los enlaces iónicos suelen formarse entre metales y no metales (NaCl). Los enlaces covalentes son frecuentes entre elementos no metálicos.
Los enlaces que unen los diferentes átomos que forman un compuesto químico pueden ser iónicos o covalentes. En los enlaces covalentes se comparten electrones, mientras que el enlace iónico supone la cesión de electrones entre átomos. Los enlaces iónicos suelen formarse entre metales y no metales (NaCl). Los enlaces covalentes son frecuentes entre elementos no metálicos.
Compuestos moleculares, están formados por moléculas, constituidas por átomos unidos mediante enlace covalente. Las moléculas se representan mediante una fórmula química que indica los tipos de átomos presentes y la proporción en que participan.
H2O: molécula formada por hidrógeno y oxígeno en proporción 2 a 1.
CCl4: molécula formada por carbono e hidrógeno en proporción 1 a 4
- Detalles
- Escrito por: Germán Fernández
- Categoría: Los compuestos químicos
- Visto: 16012
La fórmula empírica indica los átomos que participan en el compuesto así como su proporción. Por ejemplo, la glucosa tiene de fórmula empírica CH2O, que nos indica la presencia de carbono, oxígeno e hidrógeno en su estructura en proporción 1:2:1. Sin embargo, la fórmula real de la molécula de glucosa es C6H12O6.
Fórmula molecular, es la fórmula real de la molécula, nos indica los tipos de átomos y el número de cada tipo que participan en la formación de la molécula. Por ejemplo, la fórmula molecular de la glucosa, C6H12O6, nos dice que cada molécula se compone de 6 átomo de C, 12 átomos de hidrógeno y 6 átomos de óxígeno.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Los compuestos químicos
- Visto: 3186
La masa de una molécula se obtiene sumando las masas de los átomos que la componen. Veamos un ejemplo:
Calcular la masa molecular del agua sabiendo que las masas atómicas de hidrógeno y oxígeno son 1,008 y 15,999 uma.
La molécula de agua contiene dos átomos de hidrógeno y uno de oxígeno, su masa vendrá dada por la suma de dos veces la masa de hidrógeno más la masa del oxígeno.
m(H2O) = 2m(H2)+ m(O2) = 2x1,008 + 15,999 = 18,015 uma
Un mol de de una sustancia representa la cantidad en gramos igual al peso molecular y contiene 6,02214x1023 moléculas.
La masa molecular del agua es 18,015 uma, por tanto, un mol de agua son 18,015 g y contiene 6,02214x1023moléculas de agua.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Los compuestos químicos
- Visto: 3007
Vamos a calcular la composición centesimal del ácido acético: C2H4O2
- Determinación de la masa de un mol de sustancia
m(C2H4O2) = 12,01, x 2 + 1,008 x 4 + 15,99 x 2 = 60,04 g/mol
- Cálculo del porcentaje de cada elemento en el compuesto, dividiendo la masa del elemento entre la masa de un mol de compuesto
$$\%C=\frac{12,01 \cdot 2}{60,04}\cdot 100 =40,00\%$$
$$\%H=\frac{1,008 \cdot 4}{60,04}\cdot 100 =6,728\%$$
$$\%O=\frac{15,99 \cdot 2}{60,04}\cdot 100 =53,26\%$$
La deteminación experimental de la composición centesimal de un compuesto y su comparación con el cálculo teórico permite la identificación de dicho compuesto. Este tipo de análisis se realiza frecuentemente después de realizar una reacción química para comprobar que el producto obtenido es el esperado.
Obsérvese que la suma de porcentajes da 100.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Los compuestos químicos
- Visto: 2808
En este punto determinaremos la fórmula de un compuesto químico a partir de su composición centesimal obtenida experimentalmente. Veamos un ejemplo:
La composición centesimal del succinato de metilo es 62,58% de C; 9,63% de H y 27,79% de O. Su masa molecular es de 230 uma. Determinar la fórmula empírica y molecular.
- En 100 g de succinato de metilo tenemos: 62,58 g de C; 9,63 g de H y 27,7 g de O
- Conversión de las masas de los elementos a moles
$$62,58\;g\;C\cdot\frac{1\;mol\;C}{12,011\;g\;C}=5,210\;mol\;C$$
$$9,63\;g\;H\cdot\frac{1\;mol\;H}{1,008\;g\;H}=9,55\;mol\;H$$
$$27,97\;g\;O\cdot\frac{1\;mol\;O}{15,999\;g\;O}=1,757\;mol\;O$$
- Detalles
- Escrito por: Germán Fernández
- Categoría: Los compuestos químicos
- Visto: 5010
Al quemar una sustancia con fórmula molecular del tipo CxHyOz se obtiene CO2 y H2O. Todo el carbono de la muestra irá al CO2, mientras que el hidrógeno se transformará en H2O, según la ecuación química:
CxHyOz + O2 -------> x CO2 + y/2 H2O
El dióxido de carbono generado por la combustión se absorbe sobre hidróxido de sodio, determinando su masa por diferencia de pesada. Mientras que el vapor de agua se adsorbe sobre perclorato de magnesio.
Una vez determinadas las masas de CO2 y H2O se pasa a calcular la fórmula empírica. Veamos un ejemplo:
Lee más: Determinación de la fórmula empírica a partir de productos de combustión
- Detalles
- Escrito por: Germán Fernández
- Categoría: Los compuestos químicos
- Visto: 4467
El número o estado de oxidación indica los electrones que un átomo gana o pierde para unise a otros átomos y formar compuestos químicos. Apliquemos este concepto a la unidad fórmula NaCl. El sodio pierde un electrón que gana el cloro transformándose en Na+ y Cl-. El estado de oxidación del sodio es +1 y el del cloro -1.
En el MgCl2 el magnesio pierde dos electrones pasando a Mg2+, estos electrones son captados por dos átomos de cloro que se transforman en Cl-. El magnesio tiene, por tanto, estado de oxidación +2.
Para asignar el número de oxidación debemos considerar las siguientes reglas. En caso de contradicción prevalece la regla que va antes en la lista.
- El estado de oxidación de un elemento o molécula neutra es 0. Cl2 (E.O = 0); H (E.O = 0); N2(E.O = 0)
- La suma de los estados de oxidación de los átomos que forman una molécula neutra es cero. NaCl (+1-1=0); MgCl2 (+2-1-1=0)
- Los iones tienen un número de oxidación igual a su carga. SO42- (E.O = -2); NO3- (E.O = -1)
- Los metales del grupo 1 (alcalinos) tiene un número de oxidación de +1 y los del grupo 2 (alcalinoterreos) de +2.
- El átomo de flúor presenta estado de oxidación -1 en sus compuestos.
- El estado de oxidación del hidrógeno es +1, excepto cuando se combina con metales que pasa a ser -1
- El estado de oxidación del oxígeno en sus compuestos es -2
- Cuando se combinan con metales, el grupo del oxígeno tiene E.O = -2, el del nitrógeno E.O = -3 y el de los halógenos E.O = -1



