El átomo, moléculas e iones
- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 2432

Desde hace 2000 años se especula sobre la hipótesis que otorga al átomo la unidad básica que constituye toda la materia. Desde hace unos 200 años los químicos han establecido diferentes modelos atómicos en los que se considera al átomo formado por protones neutrones y electrónes. Los modelos que mayor repersusión han tenido consideran que los protones y neutrones forman un núcleo de masa elevada en torno al cual giran los electrones.
En los últimos 30 años se han desarrollado potentes microscopios (microscopio de efecto tunel) capaces de visualizar átomos individuales, prueba irrefutable de la validez de la teoría atómica.
El hombre ya utilizaba y dominaba reacciones químicas en la prehistoria, un ejemplo es la combustión (el fuego). La obtención de hierro a partir de sus minerales data del año 1300 a. C. y muchos productos químicos importantes, como el ácido nítrico (agua fuerte), ácido sulfúrico (acetite de vitriolo) y sulfato de amonio (sal de Glauber) son utilizados desde hace cientos de años.
Sin embargo, los principios fundamentales que rigen estas reacciones y permiten explicar las propiedades físicas y químicas de las sustancias no fueron establecidos hasta épocas muy recientes.
- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 4346
El filósofo griego Demócrito, en el siglo V a.C, planteó la hipótesis de que la materia estaba formada por partículas pequeñas e indivisibles a las que llamó átomos.
En 1808, el científico inglés, John Dalton, retomó las ideas de Demócrito formulándolas de modo más preciso. Las hipótesis en las que se basa la teoría de Daltón pueden resumirse en tres puntos:
- Los elementos están formados por partículas muy pequeñas llamadas átomos. Los átomos de un elemento son idénticos (igual masa, propiedades químicas) pero diferentes a los átomos de otros elementos.
- Los compuestos se forman por unión de átomos de dos o más elementos. La relación entre el número de átomos presentes en un compuesto siempre es un número entero o una fracción sencilla.
- En las reacciones químicas se produce separación, combinación o reagrupamiento de los átomos, nunca creación o destrucción de los mismos.

- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 3438
 Dalton en su teoría atómica considera el átomo como la unidad básica de un elemento que puede intervenir en una reacción química. Para Dalton el átomo era indivisible. Sin embargo, trabajos desarrollados a partir de 1850 demostraron que los átomos están formados por partículas más simples, llamadas partículas subatómicas.
Dalton en su teoría atómica considera el átomo como la unidad básica de un elemento que puede intervenir en una reacción química. Para Dalton el átomo era indivisible. Sin embargo, trabajos desarrollados a partir de 1850 demostraron que los átomos están formados por partículas más simples, llamadas partículas subatómicas.
La primera evidencia sobre la estructura atómica fue suministrada a principios de 1800 por el químico inglés Humphry Davy (1778-1829). Davy encontró que la corriente electrica descomponía ciertas sustancias, sugiriendo que los elementos de un compuesto se mantenian unidos por fuerzas eléctricas. En 1832 Michael Faraday (1791-1867) determinó la cantidad de corriente necesaria para realizar la electrólisis de una sustancia. En estudios posteriores junto con George Stoney (1826-1911) llevaron a Faraday a relacionar la unidad de carga electrica, a la que llamó electrón, con el átomo.
- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 4491
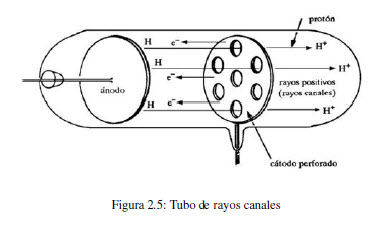
En 1886, Eugen Goldstein (1850-1930) observó que en un tubo de rayos catódicos, con el ánodo perforado, se generaba una corriente de partículas moviéndose desde el cátodo hacia el ánodo. Estos rayos positivos proceden de átomos contenidos en el tubo que han perdido electrones. Al cambiar el gas contenido en el tubo se observa un cambio en la relación e/m de la partícula positiva. Estudios realizados con diferentes gases demostraron que la la carga de los iones es múltiplo de un valor, la unidad de carga positiva, llamada protón.
- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 2336
 En 1895, el físico alemán Wilhelm Röntgen observó que el hacer incidir rayos catódicos sobre placas metálicas, estas emitian unos rayos de elevada energía, que por su naturaleza desconocida denomino rayos X.
En 1895, el físico alemán Wilhelm Röntgen observó que el hacer incidir rayos catódicos sobre placas metálicas, estas emitian unos rayos de elevada energía, que por su naturaleza desconocida denomino rayos X.
Los rayos X no eran desviados por campos electricos o magnéticos, lo cual implica que nos están formados por partículas cargadas. Además eran capaces de atravesar la materia, oscureciendo placas fotográficas cubiertas.
En 1896, Antoine Becquerel, profesor de física en París, observó como ciertos minerales de uranio desprendían de forma natural una radiación similar a los rayos X. Marie Curie, propuso el nombre de radiactividad para describir el fenómeno, llamándose materiales radiactivos a las sustancias que presentan dicha propiedad.
- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 4645
 A principios de 1900 los químicos sabían que el átomo contenía partículas cargadas negativamente (electrones) y partículas positivas (protones), tan sólo quedaba por resolver la cuestión de cómo distribuirlas en el átomo.
A principios de 1900 los químicos sabían que el átomo contenía partículas cargadas negativamente (electrones) y partículas positivas (protones), tan sólo quedaba por resolver la cuestión de cómo distribuirlas en el átomo.
J.J. Thomson propuso un modelo atómico que consistía en distribuir de forma uniforme las partículas negativas dentro de una esfera cargada positivamente. Este modelo fue denominado "budin de pasas", por el parecido que tiene con el famoso postre inglés.
- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 4504
En 1910, el físico neozelandés, Ernest Rutherford (1871-1937) junto con su colega Hans Geiger y un estudiante llamado Ernest Marsden bombardearon con partículas alfa, procedentes de una fuente radiactiva, una fina lámina de oro. Emplearon una pantalla fluorescente de sulfuro de zinc para determinar la trayectoria de las partículas después de la colisión. Observaron que la mayoría de las partículas atravesaban la lámina sin desviarse, algunas sufría una ligera variación en su trayectoria, pero una pequeña fracción (0,001%) eran desviadas un ángulo importante, observándose incluso algunos rebotes.
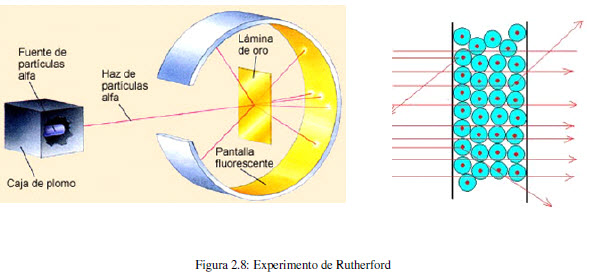
Este experimento es incompatible con el modelo de Thomson, puesto que la distribución uniforme de la carga impide explicar cambios tan importantes en la trayectoria de las particulas alfa.
- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 2216
La tercera partícula fundamental es el neutrón, descubierto en 1932 por James Chadwick (1891-1974) al bombardear una lámina de berilio con partículas alfa, observó la emisión por parte del metal de una radiación de muy alta energía, similar a los rayos gamma. Estudios posteriores demostraron que dicha radiación estaba formada por partículas neutras (no responden a los campos electricos) de masa ligeramente superior a la de los protones.
El descubrimiento del neutrón permitió entender la razón por la que el átomo de helio tiene una masa 4 veces superior a la del hidrógeno, conteniendo sólo dos protones. La explicación radica en la existencia de 2 neutrones en su núcleo.
- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 2104
El número atómico (Z) es el número de protones que posee el núcleo del átomo de un elemento químico. Si el átomo es neutro también coincide con el número de electrones que tiene en la corteza. Por ejemplo, el oxígeno tiene número atómico 8 (Z=8) esto nos indica que tiene 8 protones en su núcleo y 8 electrones en la corteza.

- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 3006
El número en masa (A) es el número de protones y neutrones presentes en el núcleo del átomo de un elemento químico. Existe una notación que permite representar el número atómico y másico de un elemento: $^A_ZX$ Conocidos los números atómico y másico de un elemento puede deducirse el número de neutrones que tendrá el núcleo de uno de sus átomos: neutrones =A - Z
Se llaman isótopos a los átomos de un elemento (igual número atómico) que presentan diferente número de masa. Así, el hidrógeno presenta tres isótopos. El hidrógeno tiene un protòn en el núcleo, sin neutrones (número atómico 1, número másico 1). El Deuterio tiene un protón y un neutrón (número atómico 1, número másico 2). El tercer isótopo del hidrógeno se llama tritio, presenta un protón y dos neutrones (número atómico 1, número masico 3). Todos los isótopos de un elemento presentan el mismo múmero atómico y diferen en el número de masa.
- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 2225
Podemos pensar que para determinar la masa de un átomo sólo debemos sumar las masas de las partículas que lo constituyen (protones, neutrones y electrones). Sin embargo, cuando se forma el núcleo se desprende una importante cantidad de energía, llamada energía nuclear, que supone una disminución en la masa del núcleo con respecto a la suma de las masa de las partículas que lo componen.
Por tanto, la determinación de las masas atómicas debe hacerse de modo experimental. En primer lugar se elige el átomo de carbono-12 como estandar y se le asigna una masa de 12 unidades de masa atómica (uma). A continuación, se determina la masa del resto de átomos con respecto al carbono-12 empleando un espectrofotómetro de masas.
Por ejemplo, los datos de un espectro de masas indican que la razón entre las masas de \(^{16}O\) y \(^{12}C\) es de 1,33291. Es decir, el oxígeno tiene una masa 1,33291 veces mayor que el carbono, la masa del oxígeno vendrá dada por: \(1,33291\;x\;12=15,9949\;uma\)
- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 1872
Con lo discutido en el punto anterior nos sorprendemos al ver que la masa del carbono es 12,011 uma, puesto que se le asignó una masa estandar de 12 uma. La razón de esta aparente incoherencia es la presencia isótopos: carbono-12, carbono-13 y carbono-14. La masa atómica del carbono se obtiene mediante la media ponderada de las masas de cada isótopo, es decir, multiplicando la abundancia de cada isótopo por su masa y sumando este resultado para todos los isótopos.
- Detalles
- Escrito por: Germán Fernández
- Categoría: El átomo, moléculas e iones
- Visto: 3170
La tabla periódica ordena los elementos según número atómico creciente, comenzando por la parte superior izquierda. Los elementos situados en la misma columna (grupo) tienen propiedades similares. Por ejemplo, el grupo 1 engloba los metales alcalinos (litio, sodio, potasio, rubidio y cesio), todos ellos buenos conductores del calor y la electricidad, presentan una violenta reacción con el agua. El grupo 2 está formado por los metales alcalinotérreos (berilio, magnesio, calcio, estroncio, bario y radio). Los elementos del grupo 17 se denominan halógenos (flúor, cloro, bromo y yodo) y los del grupo 18 gases nobles (Helio, neon, argon, kripton, xenon y radon).




