En 1910, el físico neozelandés, Ernest Rutherford (1871-1937) junto con su colega Hans Geiger y un estudiante llamado Ernest Marsden bombardearon con partículas alfa, procedentes de una fuente radiactiva, una fina lámina de oro. Emplearon una pantalla fluorescente de sulfuro de zinc para determinar la trayectoria de las partículas después de la colisión. Observaron que la mayoría de las partículas atravesaban la lámina sin desviarse, algunas sufría una ligera variación en su trayectoria, pero una pequeña fracción (0,001%) eran desviadas un ángulo importante, observándose incluso algunos rebotes.
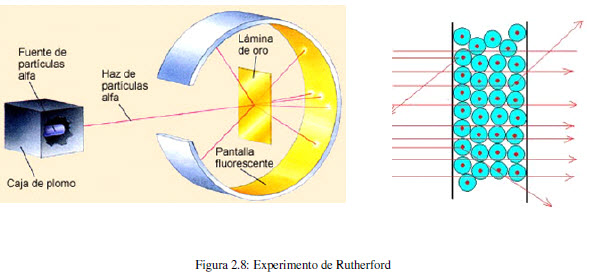
Este experimento es incompatible con el modelo de Thomson, puesto que la distribución uniforme de la carga impide explicar cambios tan importantes en la trayectoria de las particulas alfa.
Este experimento dejó a Rutherford y colaboradores atónitos. Rutherfor hizo el siguiente comentario: "Es como si usted hubiera lanzado una bala de 15 pulgadas a un trozo de papel de seda y la bala hubiera rebotado".
El análisis de los resultados del experimento, llevaron a Rutherford a platear un modelo atómico en el que las partículas positivas (protones) forman un pequeño núcleo de elevada masa, responsable de las deflexiones observadas en el experimento. Los electrones giran en torno al núcleo a grandes distancias.



