Termoquímica
- Detalles
- Escrito por: Germán Fernández
- Categoría: Termoquímica
- Visto: 3944
 La termoquímica es la parte de la termodinámica que trata los intercambios energéticos en las reacciones químicas. Aunque también existen numerosos procesos físicos que involucran transferencias de calor, como pueden ser los cambios de fase y la formación de disoluciones.
La termoquímica es la parte de la termodinámica que trata los intercambios energéticos en las reacciones químicas. Aunque también existen numerosos procesos físicos que involucran transferencias de calor, como pueden ser los cambios de fase y la formación de disoluciones.
Cuando una reacción química o proceso físico libera calor, se dice que es exotérmico. Un proceso será endotérmico cuando absorbe calor. La magnitud termodidánámica que mide estos intercambios energéticos se llama entalpía (calor a presión constante), representada por $\Delta H$
- Detalles
- Escrito por: Germán Fernández
- Categoría: Termoquímica
- Visto: 6110
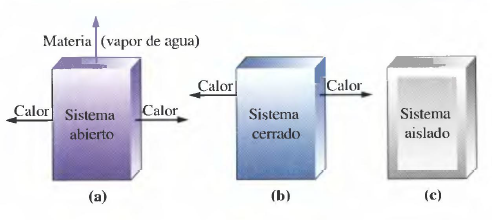 En termoquímica haremos uso de los siguientes conceptos:
En termoquímica haremos uso de los siguientes conceptos:
- Sistema: parte del universo objeto de estudio.
- Parte del universo que interacciona con el sistema.
- Sistema abierto: puede intercambiar materia y energía con el entorno.
- Sistema cerrado: puede intercambiar energía, pero no materia, con el entorno.
- Sistema aislado: no intercambia ni materia ni energía.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Termoquímica
- Visto: 4535
El calor es una forma de intercambio energético entre el sistema y sus alrededores debida a una diferencia de temperatura. Los sistemas termodinámicos no poseen calor, poseen energía, y una de las formas en que intercabian esta energía es el calor.
El calor siempre fluye desde el cuerpo de mayor temperatura al de menor temperatura, hasta alcanzar el equilibrio térmico, en cuyo momento las temperaturas de ambos cuerpos se igualan.
La transferencia de calor no solo puede causar cambios de temperatura, también puede dar lugar a cambios en el estado de agregación de la materia, fusión de sólidos, vaporización de líquidos.... Durante estos cambios de fase la temperatura permanece constante, empleándose la energía calorífica en vencer las fuerzas de interacción entre las moléculas que componen en sólido, en el caso de la fusión. En la vaporización la energía calorífica se utiliza para vencer las fuerzas entre moléculas de líquido y permitir que pasen a fase vapor.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Termoquímica
- Visto: 2399
Voy a ilustrar cómo determinar el calor específico de una sustancia, mediante un procedimiento muy visual ,expuesto por Ralph Petrucci en su libro "Química General".
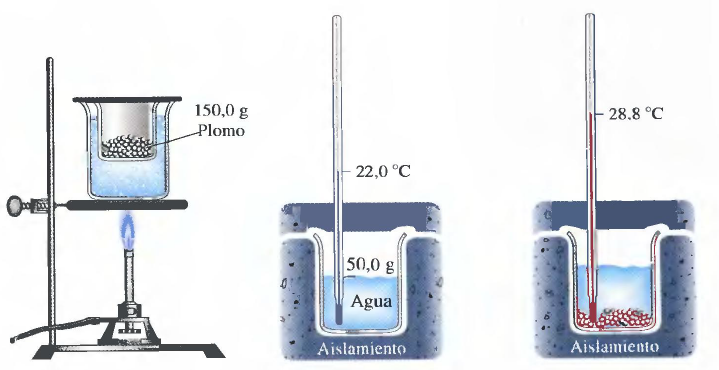
La sustancia de la que determinaremos su calor específico es el plomo. El primer paso consiste en calentar el plomo a una temperatura conocida. Una forma muy sencilla es calentarlo al baño maría llevando el agua a ebullición, lo que garantiza una temperatura de 100ºC.
- Detalles
- Escrito por: Germán Fernández
- Categoría: Termoquímica
- Visto: 1980
¿Cuánto calor hace falta para elevar la temperatura de 100 g de agua de 20 a 80ºC?. El calor específico del agua es de 4.18 J/gºC.



