 Dalton en su teoría atómica considera el átomo como la unidad básica de un elemento que puede intervenir en una reacción química. Para Dalton el átomo era indivisible. Sin embargo, trabajos desarrollados a partir de 1850 demostraron que los átomos están formados por partículas más simples, llamadas partículas subatómicas.
Dalton en su teoría atómica considera el átomo como la unidad básica de un elemento que puede intervenir en una reacción química. Para Dalton el átomo era indivisible. Sin embargo, trabajos desarrollados a partir de 1850 demostraron que los átomos están formados por partículas más simples, llamadas partículas subatómicas.
La primera evidencia sobre la estructura atómica fue suministrada a principios de 1800 por el químico inglés Humphry Davy (1778-1829). Davy encontró que la corriente electrica descomponía ciertas sustancias, sugiriendo que los elementos de un compuesto se mantenian unidos por fuerzas eléctricas. En 1832 Michael Faraday (1791-1867) determinó la cantidad de corriente necesaria para realizar la electrólisis de una sustancia. En estudios posteriores junto con George Stoney (1826-1911) llevaron a Faraday a relacionar la unidad de carga electrica, a la que llamó electrón, con el átomo.
Las primeras evidencias experimentales sobre la existencia de los electrones derivan de los estudios realizados con el tubo de rayos catódicos. Este dispositivo, empleado en los monitores de televisión, consiste en un tubo de vidrio del cual se ha evacuado casi todo el aire y en el que se introducen dos placas (electrodos) conectados a una fuente de alto voltaje. Se observa que el electrodo negativo (cátodo) emite un rayo invisible que se dirige hacia el electrodo positivo (ánodo). Empleando un electodo positivo perforado y colocando detrás una pantalla fluorescente se puede observar qie el rayo sigue una trayectoria recta.
En posteriores experimentos se somente el haz de rayos catódicos a campos electricos y magnéticos, observado desviaciones con respecto a la trayectoria rectilínea que implica la presencia de partículas con carga negativa en dicho rayo (electrones).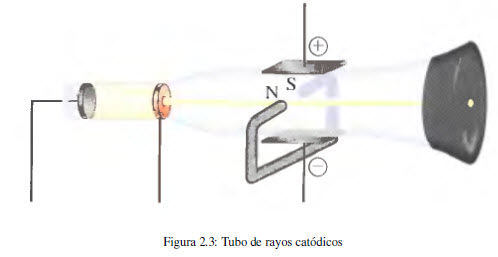
En 1897 J.J Thomson (1856-1940) estudió el cambio en la trayectoria de la rayos catódicos al ser sometidos a campos electricos y magnéticos simultáneos obteniendo la relación entre la carga y la masa del electrón.
e/m = 1,75882 108 coulombios/gramo
Una vez determinada la relación entre la masa y la carga es necesario diseñar un nuevo experimento que permita calcular una de las dos magnitudes, obteniéndose a partir de dicha relación la otra.
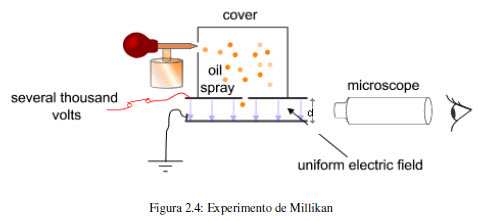
En 1909, Robert Millikan (1868-1953) realizó un experimento que permitió determinar la carga del electrón. El experimento de Millikan consistia en pulverizar aceite y estudiar el movimiento de las finas gotas en el interior de un campo electrico. Las gotas se cargaban electricamente por acción de Rayos X y ajustando el voltaje entre las placas se consigue compensar la fuerza gravitacional con la fuerza electrostática, en este punto la gota levita y el potencial aplicado permite el cálculo de la carga electrica. Este valor es 1,60218 10-19 culombios. Dado que la relación carga/masa es de 1,75882 108 C/g, mediante un simple factor de conversión se obtiene la masa del electrón.
\begin{equation}
m=\frac{1\;g}{1,75882\;10^{8}\;C}\;1,60218\;10^{-19}\;C=9,10940\;10^{-28}\;g
\end{equation}
La masa del electrón es 1836 veces menor que la masa del átomo de hidrógeno.



