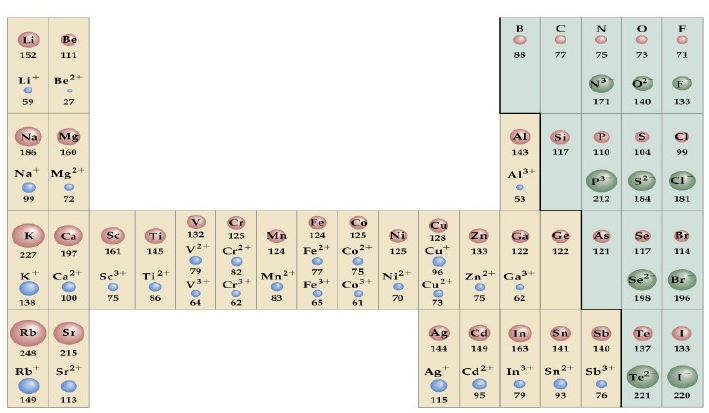
Dado que la densidad electrónica de un átomo no se hace cero nunca resulta difícil definir el tamaño de los átomos. Una posibilidad es considerar el radio de la esfera que contiene una probabilidad elevada de encontrar el electrón, por ejemplo del 90$\%$. Sin embargo, estamos más interesados en conocer el tamaño de los átomos cuando están enlazados, formando compuestos covalentes o iónicos.
Se define el radio covalente como la mitad de la distancia entre los núcleos dos átomos iguales unidos por un enlace covalente simple. El radio iónico es la distancia entre los núcleos de dos átomos unidos por un enlace iónico. En este último caso la distancia debe repartirse de forma correcta entre el catión (más pequeño) y el anión (más grande).
- Aumento del radio atómico en un grupo. Al incrementarse el valor de n se desplaza la densidad de probabilidad hacia valores más elevados de r, dando lugar a un átomo más grande. Se observa un incremento importante del radio al pasar del Li al Na y del Na al K. El aumento de radio en elementos de número atómico elevado (paso del potasio al rubidio) es menor debido a la existencia de subcapas d y f que apantallan el núcleo con menor efectividad que las s y p, haciendo que los electrones externos se encuentren más atraídos por el núcleo.
- Disminución del radio atómico en un periodo. Al movernos hacia la derecha en un periodo se produce un incremento de la carga nuclear efectiva que actúa sobre los electrones externos, comprimiendo el átomo. En el caso particular de los elementos de transición esta variación es pequeña debido a que los electrones se van metiendo en una subcapa (n-1)d interna que contribuye al apantallamiento de los electrones externos, ns.
En cuanto al radio iónico se cumple que:
- Los cationes son más pequeños que el átomo del que provienen. El catión se forma por pérdida de uno o más electrones externos, estando el resto más atraídos por el núcleo.
- Los aniones son más grandes que el átomo del que proceden. Los aniones se forman cuando el átomo neutro captura uno o más electrones. Este exceso electrónico produce una disminución de la carga nuclear efectiva, que se traduce en una menor atracción de los electrones externos por parte del núcleo.
- Los cationes isoelectrónicos son tanto más pequeños cuanto mayor sea su carga, mientras que los aniones isolectrónicos son tanto mayores cuanto mayor sea su carga.
Vídeo:



