La energía de ionización, I, es la energía necesaria para arrancar un electrón a un átomo gaseoso, aislado y en estado fundamental. Los electrones se encuentran atraídos por el núcleo y es necesario aportar energía para arrancarlos. Siempre se pierden los electrones de la última capa, que son los más débilmente atraídos por el núcleo. \begin{equation} Mg(g) \rightarrow Mg^{+}(g)+1e^{-} \end{equation} Esta ecuación representa la primera ionización del Mg y requiere $I_1$=738 kJ/mol.
Es posible continuar arrancando electrones al ion $Mg^+$ obteniendo el $Mg^{2+}$. Esta segunda ionización siempre requiere más energía que la primera ($I_2$=1451 kJ/mol).
El $Mg^{2+}$ tiene la misma configuración electrónica que el Ne, siendo relativamente fácil formar este ion. Sin embargo, tratar de arrancar más electrones al magnesio tiene un coste energético mucho mayor, observándose un incremento muy importante en la tercera energía de ionización.
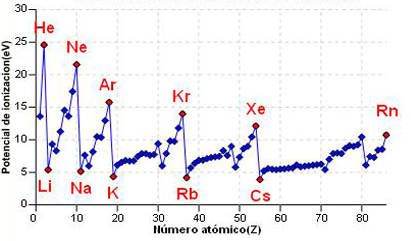
Ahora vamos a ver como varían las energías de ionización a lo largo de la tabla periódica.
- Al bajar en un grupo la energía de ionización disminuye. Los electrones entran en capas cada vez más alejadas del núcleo, estando cada vez menos atraídos lo que facilita su extracción del átomo. Veamos una ecuación, aunque sólo exacta para el hidrógeno, nos da una aproximación a la energía de ionización de átomos polielectrónicos: \begin{equation} I=R_H\frac{Z_{ef}^2}{n^2} \end{equation} El bajar en un grupo n aumenta mientra que la carga nuclear efectiva camba poco (aumenta ligeramente), lo que produce una disminución significativa en la enegía de ionización.
- Al movernos a la derecha en un periodo la energía de ionización aumenta, debido al aumento importante de la carga nuclear efectiva, sin cambio en n.

Ahora vamos a analizar algunas excepciones. El aluminio tiene menos energía de ionización que el magnesio debido a que un electrón 3p es más energético que un 3s, y por tanto más fácil de arrancar. El azufre tiene menos energía de ionización que el fósforo debido a que empieza a completar uno de los orbitales de la subcapa 3p. La repulsión entre los dos electrones que entran en el mismo orbital hace más fácil su sutración, en comparación con el fósforo que tiene toda la subcapa p semiocupada.
Vídeo:



