La ley de Boyle se aplica a procesos que mantiene la temperatura y la masa de gas constantes, por otro lado, la ley de Charles mantiene la presión y la masa de gas constante. Consideremos ahora un proceso en el que cambie la presión el volumen y la temperatura.![]()
Vamos a dividir el proceso en dos etapas, en la primera se mantiene constante la temperatura y en el segundo la presión.
Apliquemos la ley de Boyle a la primera etapa:![]()
Ahora aplicaremos la ley de Charles a la segunda etapa: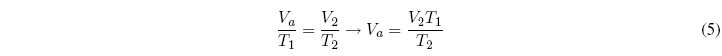
Igualando ambas ecuaciones: 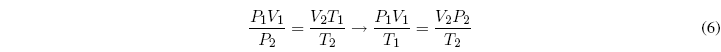
A m = cte, siendo m la masa del gas se puede escribir: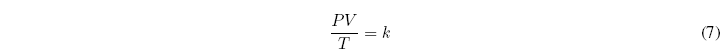
Consideremos ahora la variación de la masa manteniendo constantes la presión y la temperatura del gas, se llega a la relación: ![]() , como la masa está directamente relacionada con el número de moles se puede escribir la ecuación anterior como:
, como la masa está directamente relacionada con el número de moles se puede escribir la ecuación anterior como: ![]() , donde n representa el número de moles del gas.
, donde n representa el número de moles del gas.
La constante de proporcionalidad k, es una constante universal, llamada constante del gas ideal y se acostumbra a representar por R. Así, la ecuación de estado de los gases ideales se puede escribir como:![]()
Donde R = 0.082 atml/Kmol = 8.314 J/molK = 1,987 cal/molK
Esta ley sólo es exacta en el límite de presión cero.



