Un gas ideal cumple la ecuación de estado PV = nRT. Las interacciones entre moléculas del gas son despreciables, es decir, no existen fuerzas intermoleculares. En un gas ideal el cambio de volumen no afecta a la energía interna siempre que se mantenga la temperatura constante. Una disminución de volumen provoca que las moléculas se encuentren más cercanas, pero como no existen interacciones entre ellas la energía interna no se modifica.
Un gas ideal se define como aquel que cumple las siguientes ecuaciones:
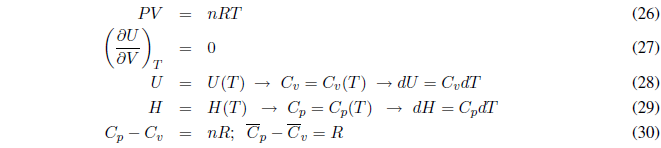
A continuación consideremos algunos procesos particulares con gases ideales.



