Cuando un sistema termodinámico pasa de un estado 1 a otro 2, se dice que ha sufrido un proceso termodinámico. Se llama trayectoria o camino a los estados termodinámicos intermedios que llevan del estado 1 al 2. Dos procesos con trayectorias diferentes pueden conectar los mismos estados inicial y final.
Estudiemos ahora algunos procesos particulares:
(a) Proceso cíclico, los estados inicial y final son el mismo. Todas las funciones de estado serán nulas para este proceso.
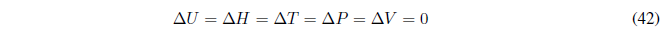
Sin embargo, \(q\) y \(w\) no tienen porqué ser cero para un proceso de este tipo ya que no son funciones de estado y su valor depende de la trayectoria que sigue el sistema para ir del punto 1 al 2.
(b) Cambio de fase reversible a T y P constantes, el calor intercambiado es el calor del cambio de fase que puede ser medido experimentalmente. El trabajo se calcula con la integral:
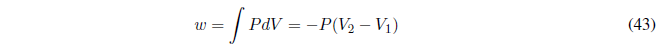
Los volúmenes inicial y final se pueden calcular a partir de la densidad de las sustancias o en caso de ser un gas ideal a partir de la ecuación de estado \(PV=nRT\).
El cambio de entalpía coincide con el calor intercambiado en el cambio de fase, \(\Delta H=q_p\).
La variación de energía interna se calcula con el primer principio, \(\Delta U=q_p + w\)
(c) Calentamiento a presión constante sin cambio de fase, comenzamos calculando el trabajo, . El calor intercambiado coincide con el cambio de entalpía que puede obtenerse a partir de la siguiente ecuación:
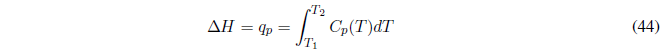
ecuación válida a P constante.
El cambio de energía interna se calcula con el primer principio: \(\Delta U =q_p +w\)
(d) Calentamiento a volumen constante sin cambio de fase, dado que el volumen se mantiene constante \(w = 0\) y el calor es igual a la variación de energía interna, que se puede calcular con la ecuación:
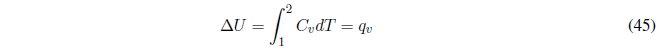
El cambio de entalpía debe calcularse a partir del cambio de energía interna con la expresión, $\Delta H=\Delta U+\Delta(PV)$ , que a volumen constante queda: \(\Delta H=\Delta U +V\Delta P\).
(e) Expansión adiabática de un gas perfecto en el vacío, en una expansión contra en vacío no se realiza trabajo \(w=0\). Como el proceso es adiabático no hay intercambio de calor \(q=0\). Por el primer principio la variación de energía interna también es nula. El calculo del cambio de entalpía puede realizarse con la ecuación, \(\Delta H=\Delta U +P\Delta (PV)= \Delta U +nR\Delta T=0\). En este proceso no puede existir cambio de temperatura ya que supondría cambio en la energía interna del gas.



