¿Qué es la energía interna? Para entender el concepto de energía interna, consideremos un gas. Cada molécula del gas posee cuatro tipos de energía:
Energía traslacional, es energía cinética debida al movimiento de la molécula.
Energía vibracional, es la energía de vibración de los átomos entorno al enlace que los une.
Energía rotacional, debida a la rotación de la molécula.
Energía electrónica, producida por transiciones electrónicas. Sólo tiene importancia a temperaturas elevadas.
La suma de estos cuatro tipos de energía nos da la energía total de una molécula. Sumando la energía de todas las moléculas obtendremos la energía interna del gas. Obsérvese que un gas monoatómico sólo tiene energía traslacional y electrónica puesto que no puede rotar ni vibrar.
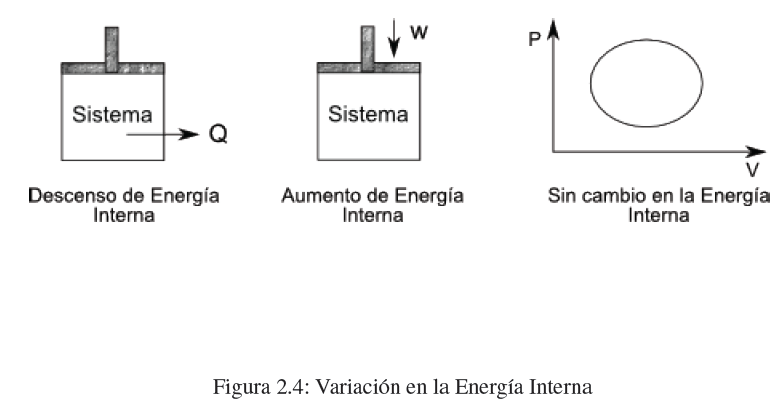
¿Cómo podemos cambiar la energía interna de un sistema? El cambio de energía interna de un sistema se produce por intercambios de calor y/o trabajo. Al realizar trabajo o aportar calor a un sistema aumentamos su energía interna. Si el sistema cede calor o realiza trabajo sobre los alrededores disminuye su energía interna.
Se puede escribir el primer principio de la termodinámica como sigue:
Donde \(\Delta U\) es la variación de energía interna, q es el trabajo absorbido \((q>0)\) o desprendido por el sistema (q<0) y w representa el trabajo realizado sobre el sistema w>0 o por el sistema sobre el entorno \((w<0)\).
El primer principio nos dice que la energía se conserva, es el principio de conservación de la energía. La energía interna de un sistema puede transformarse en calor o trabajo. El calor y el trabajo pueden convertirse en energía interna, pero siempre se cumplirá que la suma del calor y el trabajo son iguales a la variación de energía interna.
La energía interna es una función de estado. Para cualquier proceso, el cambio de energía interna sólo depende de los estados inicial y final del sistema y es independiente del camino seguido. Para un proceso en el que el sistema va desde un estado 1 a otro 2, el cambio de energía interna viene dado por la expresión:
Además en todo proceso cíclico la variación de energía interna es nulo.
\(\Delta U=0\) , proceso cíclico.
Al contrario que la energía interna el calor y el trabajo no son funciones de estado y para poder calcularlas es necesario conocer la trayectoria seguida por el sistema a lo largo de todo el proceso que nos lleva del punto 1 al 2.
Tanto calor, trabajo como energía interna tienen unidades de Julios. Otra unidad de energía muy utilizada es la caloría.
Para sustancias puras se define la energía interna molar \(\bar{U}=U/n\), siendo n el número de moles de la sustancia pura.



