La afinidad electrónica (AE) se define como la energía intercambiada (suele liberarse) cuando un átomo gaseoso aislado y en estado fundamental coge un electrón para formar un anión. Así el átomo de F libera 328 kJ/mol cuando captura un electrón y se transforma en $F^-$. El anión fluoruro es muy estable por tener la configuración electrónica del neon.
\begin{equation} F(g)+1e^-\rightarrow F^-(g) \end{equation}
Aunque los átomos que más energía liberan al captar un electrón se encuentran en la tabla periódica a la derecha, se observa que metales como el litio, en estado gaseoso, también liberan energía formando aniones litio.
\begin{equation} Li(g) + e^-\rightarrow Li^-(g) \end{equation}
El calor liberado es: AE=-59.6 kJ/mol.
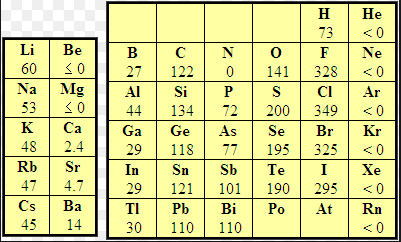
Algunos elementos como los alcalinoterreos (grupo 2) no muestran tendencia a captar electrones debido a que tienen completa la subcapa 2s. El grupo del nitrógeno tampoco tiene tendencia a coger electrones dado que supondría comenzar a competar la subcapa np.
Algunos elementos pueden coger más de un electrón, pero solo se desprende energía en la primera captura, el resto son endotérmicas.
En general la afinidad electrónica aumenta hacia la izquieda y hacia arriba, con las excepciones del grupo 2 y 15. Conviene conocer otra excepción a esta regla, que encontramos en el grupo de los halógenos: el cloro tiene mayor afinidad electrónica que el flúor. Debido a su pequeño tamaño el flúor presenta repulsiones electrónicas importantes que dificultan la captura del electrón, explicando así un valor de afinidad electrónica inferior al cloro.
Vídeo:



