La entalpía H de un sistema termodinámico se define como:![]()
La importancia de esta magnitud en química radica en el hecho de que su variación coincide con el calor intercambiado a presión constante. Es muy habitual que una reacción química se realice en un recipiente abierto (a presión atmosférica) y el calor intercambiado será un cambio de entalpía.
Partimos del primer principio de la termodinámica: ![]() , el subíndice p indica presión constante.
, el subíndice p indica presión constante.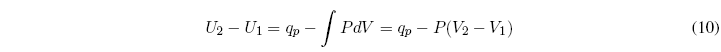
Despejando el calor y agrupando términos se obtiene: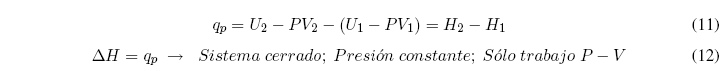
Veamos ahora que ocurre cuando el volumen del sistema se mantiene constante: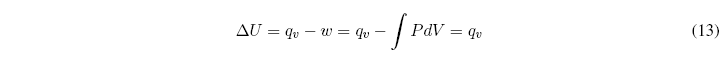
A volumen constante el trabajo es nulo y el calor intercambiado a volumen constante coincide con el cambio de energía interna.![]()
En todo proceso químico que mantenga el volumen constante, el calor intercambiado coincide con la variación de energía interna del sistema.



