Disolvente (A) \begin{equation} \mu_A=\mu_{A}^{0}+RTlnx_A \end{equation} Para definir el estado normal debemos anular el término $RTlnx_A$ y para ello hacemos $x_A \rightarrow 1$ para que $lnx_A \rightarrow 0$ \begin{equation} \mu_{A}^{0}=\mu_{A}^{\ast}(T,P) \end{equation} El estado normal del disolvente se define como disolvente puro a la temperatura y presión de la disolución.
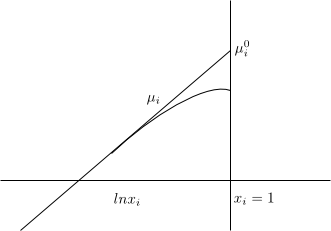
Soluto (i) \begin{equation} \mu_i=\mu_{i}^{0}+RTlnx_i \end{equation} Para definir el estado normal debemos hacer que $x_i \rightarrow 1$, pero cuando $x_i$ aumenta la disolución deja de ser diluida ideal. Esto nos obliga a definir el estado normal $\mu_{i}^{0}$ de forma ficticia.
$\mu_{i}^{0}$ se define como el estado en el cual i es puro y además cada molécula de i experimenta las mismas fuerzas intermoleculares que en una dislución diluida ideal.