La Ley de Henry nos da la presión de vapor de un soluto en una disolución diluida ideal. Para el disolvente sigue aplicándose la Ley de Raoult. $P_A=x_AP_{A}^{\ast}$
Sea una disolución diluida ideal que contiene un disolvente A y solutos (1,2...i). Vamos a calcular la presión que ejerce el soluto i en la fase gas.
Una vez alcanzado el equilibrio: \begin{equation} \mu_{i,l}(T,P)=\mu_{i,v}(T,P) \end{equation} Sustituyendo los potenciales químicos por sus valores \begin{equation} \mu_{i,l}^{0}(T,P)+RTlnx_{i}=\mu_{i,v}^{0}(T)+RTln\frac{P_i}{P^0} \end{equation}
Agrupando términos y aplicando propiedades de logaritmos neperianos \begin{equation} \frac{\mu_{i,l}^{0}(T,P)-\mu_{i,v}^{0}(T)}{RT}=ln\frac{P_i}{x_iP^0} \end{equation} Despejando \begin{equation} \underbrace{P^0e^{\frac{\mu_{i,l}^{0}(T,P)-\mu_{i,v}^{0}(T)}{RT}}}_{K_H}=\frac{P_i}{x_i} \end{equation} Donde $K_H$ es la constante de Henry \begin{equation} P_i=K_Hx_i \end{equation}
Solubilidad de gases en líquidos
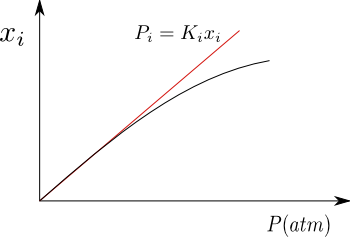
Para los gases poco solubles en líquidos, la disolución se aproxima a ideal, cumpliendo la Ley de Henry para el soluto. Como puede observarse en la gráfica, cuando la presión es elevada se produce una desviación respecto a Henry, debido a que la disolución deja de comportarse como diluida ideal.