Vamos a calcular la frecuencia de colisión de las moléculas de un gas con la pared de un recipiente en un dt.
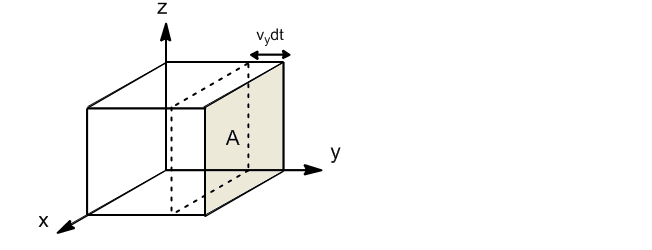
Si tomamos la pared perpendicular al eje y, sólo las moléculas con componente y de velocidad chocarán contra dicha pared. La fracción de moléculas con componente y de velocidad comprendida entre $v_y$ y $v_y+dv_y$ viene dada por: \begin{equation} \frac{dN_{v_y}}{N}=g(v_y)dv_y \end{equation} Solamente las moléculas que se encuentran a una distancia $v_ydt$ de la pared podrán chocar contra ella en el dt. El volumen de la caja en el que se encuentran las moléculas que pueden chocar contra la pared sera: $V'=Av_ydt$. Dividiendo este voluen entre el total $V'/V$ se obtiene la fracción de moléculas que por su proximidad a la pared pueden chocar.
Multiplicando el número de moléculas que tienen la velocidad comprendida entre $v_y$ y $v_y+dv_y$ por la fracción de moléculas que pueden llegar a la pared en el dt obtenemos: \begin{equation} dN_{p,v_y}=\frac{V'}{V}dN_{v_y}=\frac{Av_ydt}{V}Ng(v_y)dv_y \end{equation} Integrando en el intervalo $v_y[0,\infty]$, obtenemos las colisiones totales: \begin{equation} dN_p=\int_{0}^{\infty}\frac{Av_ydt}{V}Ng(v_y)dv_y=\frac{ANdt}{V}\int_{0}^{\infty}v_yg(v_y)dv_y \end{equation} Evaluando el promedio de $v_y$ \begin{equation} \int_{0}^{\infty}g(v_y)v_ydv_y=\int_{0}^{\infty}\left(\frac{m}{2\pi kT}\right)^{1/2}e^{\frac{-mv_{y}^{2}}{2kT}}v_ydv_y=\left(\frac{kT}{2\pi m}\right)^{1/2} \end{equation} Llevando este resultado a la ecuación de colisiones por unidad de tiempo. \begin{equation} dN_p=A\frac{NAdt}{V}\left(\frac{kT}{2\pi m}\right)^{1/2} \end{equation} Esta última ecuación representa el número de moléculas que colisionan contra la pared de área A en un dt.
Definimos la frecuencia de colisión por unidad de área y tiempo como:$Z_p=\frac{1}{A}\frac{dN_p}{dt}$ \begin{equation} Z_p=\frac{N}{V}\left(\frac{kT}{2\pi m}\right)^{1/2}=\frac{1}{4}\left(\frac{8kT}{2\pi m}\right)^{1/2}\frac{N}{V}=\frac{1}{4}\bar{v}\frac{N}{V} \end{equation} Siendo $\bar{v}$ el módulo de la velocidad media. \begin{equation} Z_p=\frac{1}{4}\bar{v}\frac{N}{V} \end{equation} La frecuencia de colisión depende de la densidad del gas $(N/V)$ y de la velocidad media de las moléculas. A mayor densidad y velocidad media habrá mayor frecuencia de colisiones. De la ecuación de estado del gas ideal, $PV=\frac{N}{N_A}RT$ y considerando que, $k=R/N_A$, se obtiene, $\frac{N}{V}=\frac{P}{kT}$. Con este resultado podemos simplificar la ecuación anterior. \begin{equation} Z_p=\frac{1}{4}\bar{v}\frac{N}{V}=\frac{1}{4}\left(\frac{8kT}{\pi m}\right)^{1/2}\frac{P}{kT} \end{equation} Agrupando términos nos queda: \begin{equation} Z_p=\frac{P}{(2\pi mkT)^{1/2}} \end{equation} El cálculo de $Z_p$ para el oxígeno a 298K y 1atm da: $2.7x10^{23}\;col/cm^2s$



