Consideremos un sistema con un sólo componente $(H_2O)$ despreciamos la disociación. Vamos a representar cualquier estado del sistema mediante un diagrama de fases.
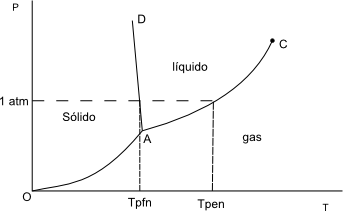
A temperaturas bajas y presiones moderadas o altas tenemos la fase sólida. A presiones bajas la fase gaseosa y a temperaturas y presiones intermedias la fase líquida.
- OA: Equilibrio de fases sólido-gas, nos da los puntos de sublimación del sólido.
- AD: Equilibrio sólido-líquido, nos da los puntos de fusión.
- AC: Equilibrio líquido-gas, nos da los puntos de ebullición.
- A: Punto triple. Punto en el que coexisten las tres fases: sólido, líquido y gas.
- C: Punto crítico. Por encima de $T_c$ no es posible licuar un gas por compresión.
Fijada la presión a 1 atm los puntos de corte con las líneas AD y AC nos dan los puntos de fusión normal y ebullición normal (para el agua 0ºC y 100ºC).
En el punto crítico la densidad de la fase líquida y vapor se igualan, líquido y gas tienen las mísmas propiedades.



