Según la interpretación de Born el módulo al cuadrado de la función de onda nos da la densidad de probabilidad, probabilidad de encontrar la partícula en unas determinadas coordenadas. En esta sección vamos a representar las densidades de probabilidad de los orbitales mediante superficies que contienen la mayor parte de la probabilidad de encontrar el electrón.
Recordemos que las funciones de onda hidrogenoides se componen del producto de una parte radial $R(r)$ por una parte angular $Y(\theta,\varphi)$, denominada armónico esférico. La parte radial depende de los números cuánticos n y l, mientras que la parte angular la hace de l y m.
Para obtener la función de onda del estado fundamental del átomo de hidrógeno multiplicamos la función radial $R(1s)=2(Z/a)^{3/2}e^{-Zr/a}$ por el armónico esférico $Y_{00}=1/\sqrt{4\pi}$:
\begin{equation} \psi_{1s}=\frac{1}{\sqrt{\pi}}\left(\frac{Z}{a}\right)^{3/2}e^{-Zr/a} \end{equation}
En el caso del átomo de hidrógeno Z=1, y la ecuación para la función de onda nos queda:
\begin{equation} \psi_{1s}=\frac{1}{\sqrt{\pi}}\left(\frac{1}{a_0}\right)^{3/2}e^{-r/a_0} \end{equation}
Elevando al cuadrado la función de onda obtenemos la densidad de probabilidad:
\begin{equation} \psi^2(1s)=\frac{1}{\pi a_0^3}e^{-2r/a_0} \end{equation}
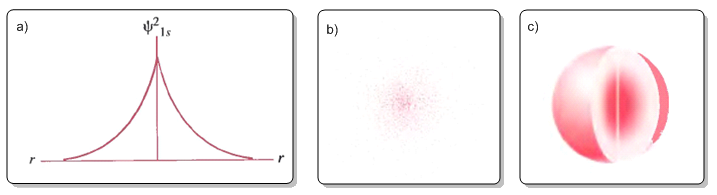
En la figura (a) se representa la densidad de probabilidad electrónica $\psi^2$ frente a r. La figura (b) representa la densidad de probabilidad como densidad de puntos. La figura (c) es la tipica representación del orbital 1s en la que se delimita la zona del espacio con una probabilidad de encontrar el electrón de 0,9.
Para el orbital 2s la función radial viene dada por la ecuación:
\begin{equation} R(2s)=\frac{1}{\sqrt{2}}\left(\frac{Z}{a}\right)^{3/2}\left(1-\frac{Zr}{2a}\right)e^{-Zr/2a} \end{equation}
La parte angular del orbital 2s sigue siendo el armónico $Y_{00}=\frac{1}{\sqrt{4\pi}}$. El producto de ambos factores da lugar a la función de onda del orbital 2s.
\begin{equation} \psi(2s)=\frac{1}{\sqrt{\pi}}\left(\frac{Z}{2a}\right)^{3/2}\left(1-\frac{Zr}{2a}\right)e^{-Zr/2a} \end{equation}
El cuadrado de esta función nos da la densidad de probabilidad, que podemos representar de diferentes formas, igual que hicimos con el orbital 1s.
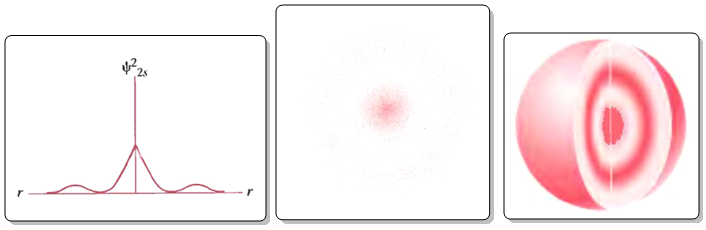
En el caso del orbital 2s nos encontramos con un nodo radial (punto de densidad de probabilidad nula) que se transfiere al orbital en forma de un superficie nodal esférica. El número de nodos radiales o superficies nodales esféricas viene dado por la expresión: n-l-1
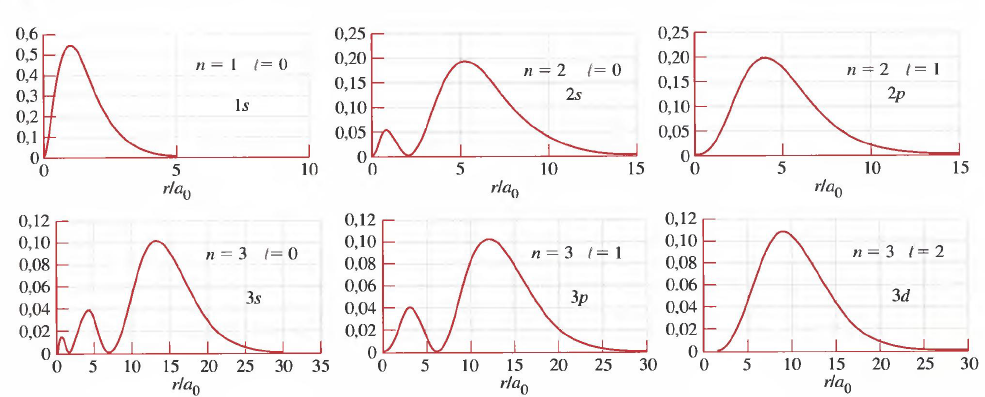
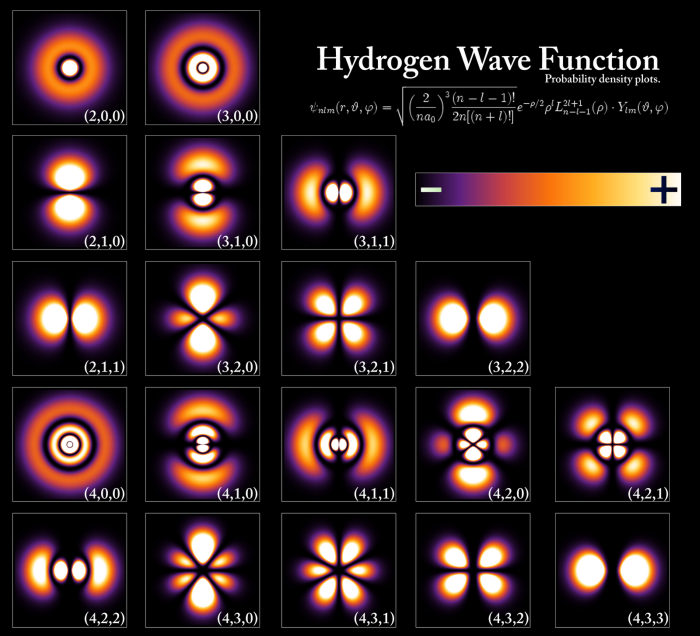
En la siguientes imagenes se muestran las densidades de probabilidad radial, obtenidas al representar $4\pi r^2R_{nl}^2$ frente a la coordenada radial (r), así como la zona del espacio con una probabilidad de encontrar el electrón muy elevada (98%), conocida como orbital.