La energía reticular nos da una medida de la estabilidad de un compuesto iónico, y se defiene como la energía necesaria para separar completamente un mol de un compuesto iónico sólido en sus iones en estado gaseoso. Cuando los iones se unen para formar la red cristalina se desprende calor (proceso exotérmico), el compuesto iónico es más estable que los iones separados. Para romper el compuesto iónico separando los iones que lo forman es necesario dar una energía (igual a la desprendida al formarse) llamada reticular.
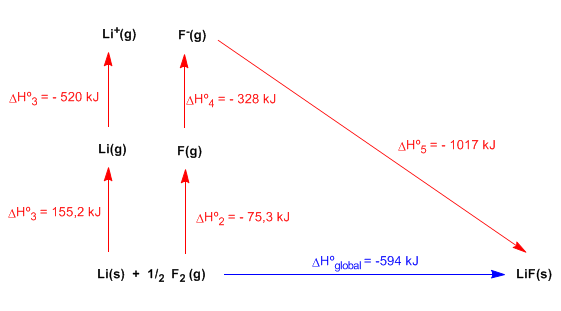
El ciclo de Born-Haber permite obtener la energía reticular de un compuesto iónico mediante las siguientes etapas, analizadas para la formación del LiF(s):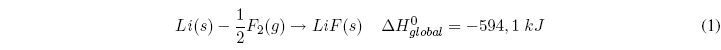
- Paso del litio sólido a gas. Aplicamos el calor de sublimación del litio: \(\Delta H_{sub}=155,2\;kJ/mol\)
![]()
- Disociación de la molécula de flúor. Obsérvese que sólo es necesario disociar medio mol: \(\Delta H_{dis}^{0}=150,6\;kJ/mol\)
![]()
- Ionización de 1 mol de litio gas.
![]()
- Adición de 1 mol de electones al flúor gas.
![]()
- Combinación de 1 mol de litio y 1 mol de Flúor para formar el compuestos LiF sólido.
![]()
La suma de las 5 etapas nos da la reacción global y aplicando la Ley de Hess podemos determinar la energía reticular.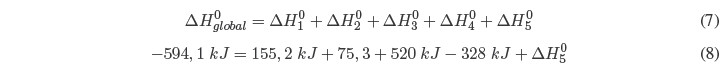
Despejando \(\Delta H^{0}_{5}\)![]()