La velocidad de una reacción puede depender fuertemente del disolvente. Como ejemplo, sea la $S_N2$: $CH_3I + Cl^- \rightarrow CH_3Cl + I^-$, la velocidad depende del disolvente ya que este cambia el valor de k, debido a la distinta solvatación de los reactivos. En otras ocasiones, reacciones muy rápidas se ven limitadas por la velocidad de difusión de los reactivos a través del disolvente (viscosidad del disolvente). El valor de k también depende de los puentes de hidrógeno. Una reacción que puede transcurrir a través de dos mecanismos competitivos, las velocidades pueden verse afectadas y seguir un mecanismo en un disolvente y el otro en otro disolvente diferente.
Encuentros, colisiones y el efecto de celda
En un gas las moléculas están distantes y se mueven libremente. En un líquido, una molécula se encuentra rodeada por otras moléculas "celda de disolvente". Esta molécula choca contra las paredes de la celda antes de poder escapar.
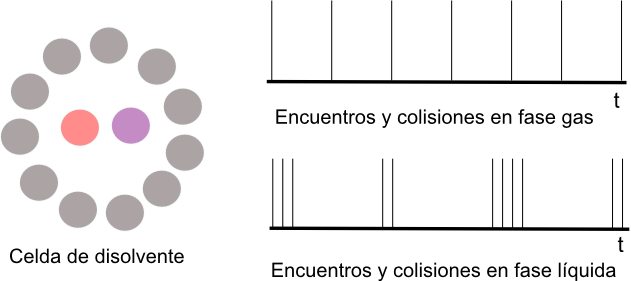
Cuando dos moléculas reactivas A y B están en disolución deben difundir por el disolvente para poder encontrarse. Sin embargo, una vez que se encuentran, serán rodeadas por el disolvente que las conservará próximas durante un tiempo largo, chocando muchas veces antes de salir de la celda, lo que favorece que puedan reaccionar. Cuando A y B se encuentran en la misma celda, se llama encuentro. Cada choque, se llama colisión.
Reacciones controladas por la difusión
Supongamos que la reacción $A + B \rightarrow C$, tiene una energía de activación baja, por lo tanto hay una elevada probabilidad para que la reacción se produzca en cada colisión. Como en cada encuentro se producen muchas colisiones, es muy probable que se produzca reacción cada vez que A y B se encuentran. El número de encuentros depende de la velocidad con la que difunden A y B en la disolución. Estas reacciones tienen una velocidad controlada por la difusión.



