Medidas de conductividad indican que el agua pura está parcialmente ionizada. Los iones se generan cuando unas moléculas de agua actúan como ácidos cediendo protones a otras moléculas de agua que actúan como bases, según el siguiente equilibrio.
$H_2O + H_2O \rightleftharpoons H_3O^+ + OH^-$
Se trata de una reacción reversible muy desplazada hacia la izquierda. Las cantidades de iones oxonio e hidróxido presentes en el medio es muy pequeña.
La constante de equilibrio de esta reacción se denomina producto iónico del agua, $K_w$
$K_w=[H_3O^+][OH^-]=10^{-14}$
En el agua pura las concentraciones de ambos iones es igual: $[H_3O^+]=[OH^-]=10^{-7}$
Dado que $K_w$ es una constante, en todo momento el producto de las concentraciones de iones oxonio e hidróxido debe ser $10^{-14}$. Por tanto, si añadimos al agua pura un ácido aumentando la concentración de protones de la disolución, la concentración de iones hidróxido debe disminuir para mantener el valor de $K_w$
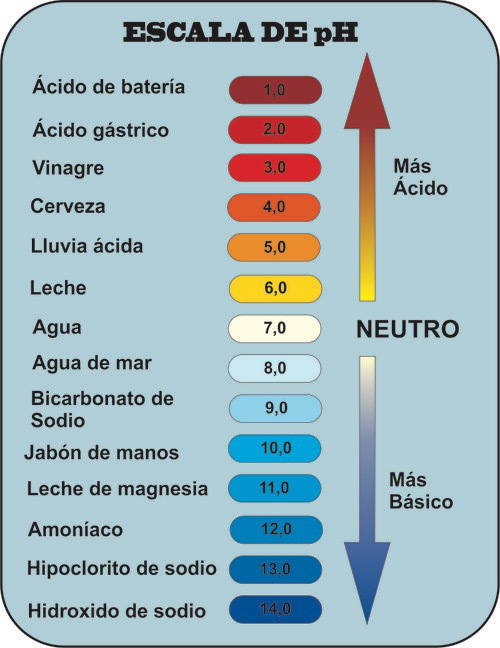 Escala de pH
Escala de pH
En 1909, el químico danés Soren Sorensen definió el pH como:
$pH=-log[H_3O^+]$
El pH nos da el grado de acidez que presenta una disolución.
Así, en el agua pura $[H_3O^+]=10^{-7}$ M y su $pH=-log(10^{-7})=7$.
- De modo que consideramos que todas las disoluciones acuosas a 25ºC con pH=7 son neutras.
- Cuando el pH es mayor de 7 la disolución es básica.
- Cuando el pH es menor de 7 la disolución es ácida.
También podemos definir el pOH:
$pOH=-log[OH^-]$
Dado que $[H_3O^+][OH^-]=10^{-14}$, tomando logaritmos se obtiene la relación entre el pH y el pOH:
$pH+pOH=14$



