La teoría de Lewis y el modelo de RPECV nos han dado una descripción bastante precisa sobre la estructura y geometría de la molécula.![]()
Ahora intentaremos una mejor comprensión sobre la formación de los enlaces Be-Cl empleando la teoría del enlace de valencia. Para ello escribiremos la configuración electrónica del berilio, fijándonos en la capa de valencia.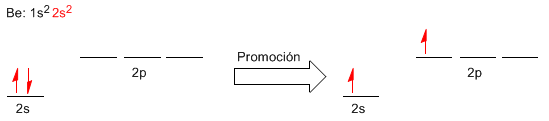
La promoción electrónica supone el paso de un electrón desde el nivel 2s al 2p de mayor energía. La promoción permite disponer de dos orbitales disponibles para formar enlaces. Podríamos explicar los dos enlaces formados en el BeCl2 por solapamiento de orbitales 3p de los cloros con los orbitales 2s y 2p del berilio. Sin embargo, los enlaces formados en el BeCl2 son iguales (misma longitud y energía), propiedades que no podemos explicar si formamos estos enlaces a partir de orbitales atómicos diferentes.

Veamos el proceso de hibridación de un modo más gráfico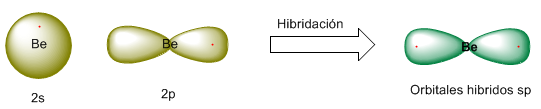
Cada uno de los dos orbitales híbridos contiene un electrón que al solapar con orbitales 3p del átomo de cloro forman los enlaces Be-Cl.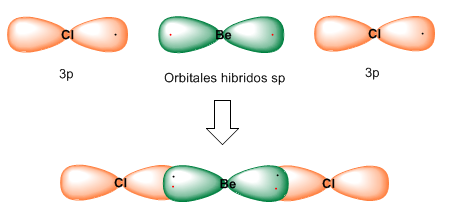
La hibridación sp da lugar a moléculas lineales con ángulos de enlace de 180º



