 Los enlaces que unen los diferentes átomos que forman un compuesto químico pueden ser iónicos o covalentes. En los enlaces covalentes se comparten electrones, mientras que el enlace iónico supone la cesión de electrones entre átomos. Los enlaces iónicos suelen formarse entre metales y no metales (NaCl). Los enlaces covalentes son frecuentes entre elementos no metálicos.
Los enlaces que unen los diferentes átomos que forman un compuesto químico pueden ser iónicos o covalentes. En los enlaces covalentes se comparten electrones, mientras que el enlace iónico supone la cesión de electrones entre átomos. Los enlaces iónicos suelen formarse entre metales y no metales (NaCl). Los enlaces covalentes son frecuentes entre elementos no metálicos.
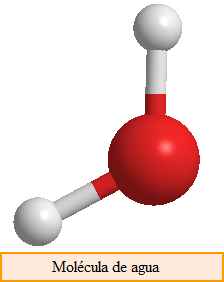
Compuestos moleculares, están formados por moléculas, constituidas por átomos unidos mediante enlace covalente. Las moléculas se representan mediante una fórmula química que indica los tipos de átomos presentes y la proporción en que participan.
H2O: molécula formada por hidrógeno y oxígeno en proporción 2 a 1.
CCl4: molécula formada por carbono e hidrógeno en proporción 1 a 4
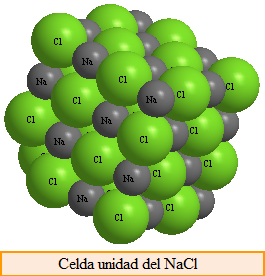 Compuestos iónicos, se forman por combinación de metales con no metales. Los átomos de elementos metálicos tienden a perder electrones que ganan los átomos de los elementos no metálicos. Cuando un metal pierde electrones forma una especie positiva llamada catión, esos electrones son ganados por el elemento no metálico formando una especie negativa llamada anión. Las fuerzas electrostáticas atraen los cationes y aniones para formar el compuesto iónico.
Compuestos iónicos, se forman por combinación de metales con no metales. Los átomos de elementos metálicos tienden a perder electrones que ganan los átomos de los elementos no metálicos. Cuando un metal pierde electrones forma una especie positiva llamada catión, esos electrones son ganados por el elemento no metálico formando una especie negativa llamada anión. Las fuerzas electrostáticas atraen los cationes y aniones para formar el compuesto iónico.
El cloruro de sodio (sal común), se forma por transferencia de un electrón desde el sodio al cloro, formándose el catión sodio y el anión cloruro. Los Na+ y Cl- se atraen para formar un cristal cuya unidad fórmula es NaCl. No podemos considerar el NaCl como una molécula puesto que cada ion sodio está rodeado por 6 cloruros y viceversa.



