Un enlace covalente se forma cuando dos átomos comparten uno o más pares de electrones. La condición para que el enlace tenga un elevado carácter covalente es que la diferencia de electronegatividad entre ambos átomos sea cero o muy pequeña. Según la teoría de Lewis el enlace que da lugar a la molécula de hidrógeno puede describirse del siguiente modo:![]()
Ambos electrones son compartidos por los dos átomos. Por simplicidad se acostumbra a respresntar el par de electrones compartidos por una línea (H-H).
Consideremos la molécula de flúor, la configuración electrónica del F es 1s22s22p5. De los electrones de valencia 2s22p5 sólo participan dos en el enlace, el resto permanecen como electrones no enlazantes, también llamados pares solitarios o libres. De esta forma ambos átomos de flúor adquieren una configuración electrónica de gas noble.
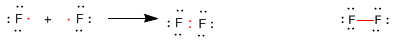
Veamos el ejemplo del agua, el oxígeno puede formar dos enlaces covalentes con el hidrógeno, alcanzando ambos configuración de gas noble. La estructura de Lewis del agua viene dada por:
En la molécula de agua el oxígeno queda con dos pares de electrones no enlazantes.
En los ejemplos propuestos se observa que los átomos tienden a rodearse de 8 electrones, con excepción del hidrógeno que se rodea de 2 electrones. Esta observación recibe el nombre de regla del octeto: "un átomo diferente del hidrógeno tiende a formar enlaces hasta que se rodea de ocho electrones de valencia".
La regla del octeto funciona correctamente con los elementos del segundo periodo, presentando excepciones importantes en los elementos de tercer y sucesivos periodos.
Veamos la regla del octeto aplicada al la formación de la molécula de amoniaco, NH3.
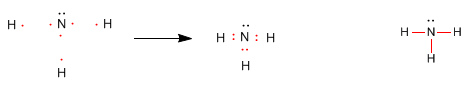
El átomo de nitrógeno requiere formar 3 enlaces covalentes con hidrógenos para competar los 8 electrones que le dan la configuración isoelectrónica al neon. Por su parte los hidrógenos adquieren la configuración isoelectrónica al helio.

El átomo de nitrógeno requiere formar 3 enlaces covalentes con hidrógenos para competar los 8 electrones que le dan la configuración isoelectrónica al neon. Por su parte los hidrógenos adquieren la configuración isoelectrónica al helio.



