Se cree que los pasos más importantes de la reacción $2H_2+O_2 \rightarrow H_2O$ corresponden a una reacción en cadena ramificada, con etapas elementales: \begin{eqnarray} H_2 & \rightarrow & 2H\\ H_2+OH & \rightarrow & H + H_2O\\ H + O_2 & \rightarrow & OH + O\\ O + H_2 & \rightarrow & OH + H\\ 2H + pared & \rightarrow & H_2\\ H+O_2+M & \rightarrow & HO_2 + M^{\ast} \end{eqnarray} El radical $HO_2$ es de larga vida, y los radicales O y OH son mucho más reactivos que el H.
1. Identifica las etapas de iniciación, propagación, ramificación y terminación.
2. Muestra que, del balance de las etapas de propagación y ramificación, el resultado es la reacción global más una generación de radicales neta.
3. Aplica la hipótesis de estado estacionario a las concentraciones de los radicales libres O y OH para hallar sus concentraciones en función de la de H (más abundante).
4. Considerando que la etapa 5 es de orden 1 (controlada por la adsorción y difusión en las paredes) y la etapa 1 es de orden cero (producida a ritmo constante por circunstancias externas), encuentra la ecuación diferencial que gobierna la generación de radicales H.
5. La solución de la ecuación diferencial tiene dos regímenes, en función del signo de b. Discute las condiciones en las que se da cada uno de esos regímenes, y su significado.
Solución
1. La reacción radicalaria en cadena ramificada consta de cuatro etapas.
- En la iniciación (1) se generan radicales que pasan a la etapa de propagación.
- En la etapa de propagación (2) se genera el producto de la reacción.
- En las dos etapas de ramificación (3)(4) un radical da lugar a dos radicales, lo que produce una aceleración de la reacción que puede llegar a originar una explosión.
- En las etapas de terminación (5)(6) los radicales se unen entre sí, debido a la desaparición de los reactivos.
2. Como puede observarse la suma de las etapas de propagación y terminación produce una generación neta de radicales. \begin{eqnarray} H_2+OH & \rightarrow & H + H_2O\\ H + O_2 & \rightarrow & OH + O\\ O + H_2 & \rightarrow & OH + H\\ -------& - & ------\\ 2H_2+O_2 & \rightarrow & H_2O + OH + H \end{eqnarray}
3. Escribimos el mecanismo especificando las constantes cinéticas de las diferentes etapas: \begin{eqnarray} H_2 & \stackrel{k_0}{\rightarrow} & 2H\\ H_2+OH & \stackrel{k_1}{\rightarrow} & H + H_2O\\ H + O_2 & \stackrel{k_2}{\rightarrow} & OH + O\\ O + H_2 & \stackrel{k_3}{\rightarrow} & OH + H\\ 2H + pared & \stackrel{k_4}{\rightarrow} & H_2\\ H+O_2+M & \stackrel{k_5}{\rightarrow} & HO_2 + M^{\ast} \end{eqnarray} Aplicamos la aproximación al estado estacionario para los radicales O. \begin{equation} \frac{d[O]}{dt}=0=k_2[H][O_2]-k_3[O][H_2] \end{equation} \begin{equation} [O]_{ee}=\frac{k_2[H][O_2]}{k_3[H_2]} \end{equation} Ahora aplicamos la aproximación al estado estacionario a los radicales OH \begin{equation} \frac{d[OH]}{dt}=0=-k_1[H_2][OH]+k_2[H][O_2]+k_3[O][H_2] \end{equation} Sustituyendo en el último término de (20) la ecuación (18), nos da: \begin{equation} \frac{d[OH]}{dt}=0=-k_1[H_2][OH]+\underbrace{k_2[H][O_2]+k_2[H][O_2]}_{2k_2[H][O_2]} \end{equation} Despejando la concentración de OH \begin{equation} [OH]_{ee}=\frac{2k_2[H][O_2]}{k_1[H_2]} \end{equation}
4. Calculamos la variación neta de radicales H en el tiempo, considerando que la primera etapa es de orden cero y la quinta de orden uno. \begin{equation} \frac{d[H]}{dt}=k_0[H_2]^{0}+k_1[H_2][OH]-k_2[H][O_2]+k_3[O][H_2]-k_4[H]-k_5[H][O_2][M] \end{equation} La ecuación (23) se simplifica si consideramos la ecuación (18) \begin{equation} \frac{d[H]}{dt}=k_0+k_1[H_2][OH]-k_4[H]-k_5[H][O_2][M] \end{equation} La ecuación (21) permite sustituir el segundo término de la ecuación (24) por $2k_2[H][O_2]$. \begin{equation} \frac{d[H]}{dt}=k_0+2k_2[H][O_2]-k_4[H]-k_5[H][O_2][M] \end{equation} Sacamos factor común a [H] en (1.10) \begin{equation} \frac{d[H]}{dt}=k_0+\left(2k_2[O_2]-k_4-k_5[O_2][M]\right)[H] \end{equation} Llamando $f=2k_2[O_2]$ y $g=k_4+k_5[O_2][M]$, la ecuación anterior se transforma en: \begin{equation} \frac{d[H]}{dt}=k_0+(f-g)[H] \end{equation}
5. Resolviendo la ecuación diferencial se obtiene el siguiente resultado: \begin{equation} [H]=\frac{k_0}{f-g}\left(e^{(f-g)t}-1\right) \end{equation} Discutimos esta solución en función de la diferencia $f-g$.
- Si g>f, f-g<0, las etapas de terminación predominan sobre las de ramificación y el aumento de [H] se hace más lento a medida que transcurre el tiempo.
- Si f>g, f-g > 0, las etapas de ramificación predominan sobre las de terminación y la [H] crece exponencialmente con el tiempo. El aumento exponencial en el número de radicales produce la explosión por ramificación.
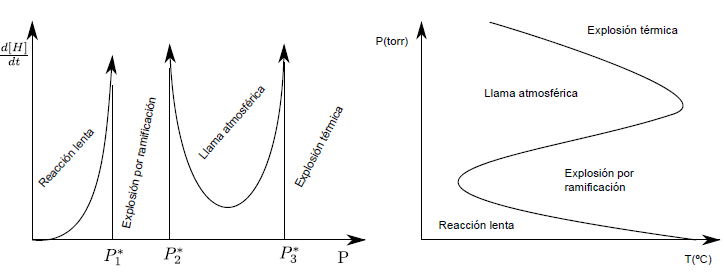
La reacción de hidrógeno con oxígeno tiene un comportamiento dependiente de la presión. Así, a presiones menores que $P_{1}^{\ast}$ la reacción es lenta. Entre $P_{1}^{\ast}$ y $P_{2}^{\ast}$ se poduce la explosión, debido a la ramificación que provoca un crecimiento exponencial de los radicales H. Entre $P_{2}^{\ast}$ y $P_{3}^{\ast}$ se produce una combustión rápida, con llama muy viva, denominada llama atmosférica. Por encima de $P_{3}^{\ast}$ se producen las explosiones térmicas debidas al calor desprendido por la reacción, que produce un aumento de la temperatura, con el correspondiente aumento de la velocidad de reacción.



