La regla de las fases intenta responder a la pregunta general de cuantas varibles independientes se necesitan para definir el estado de equilibrio de un sistema de fases y componentes múltiples.
Definimos el número de grados de libertad (f) de un sistema en equilibrio, como el número de variables intensivas independientes que se necesitan para especificar su estado termodinámico.
Inicialmente haremos dos suposiciones, que más tarde se eliminarán:
- No ocurre ninguna reacción química
- Todas las especies químicas están presentes en cada una de las fases.
Sea un sistema formado por c especies químicas diferentes y p fases.
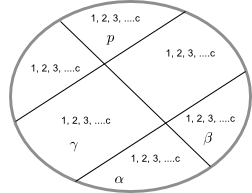
Para dar la composición del sistema necesitamos especificar las fracciones molares de cada componente en cada fase.
Composición de la fase $\alpha$: $x_{1}^{\alpha},x_{2}^{\alpha},x_{3}^{\alpha}, ........, x_{c}^{\alpha}$
Composición de la fase $\beta$: $x_{1}^{\beta},x_{2}^{\beta},x_{3}^{\beta}, ........, x_{c}^{\beta}$
..............................................................................
Composición de la fase $p$: $x_{1}^{p},x_{2}^{p},x_{3}^{p}, ........, x_{c}^{p}$
Necesitamos, por tanto, $c\times p$ fracciones molares.
Además es necesario especificar la temperatura y la presión, que deben ser las mismas en todas las fases del sistema, puesto que el sistema se encuentra en equilibrio termodinámico. Es decir, tenemos $c\times p +2$ variables.
No todas las variables son independientes, puesto que existen ecuaciones que las relacionan. Así, la suma de las fracciones molares de todos los componentes en una fase debe dar 1.
\begin{eqnarray} x_{1}^{\alpha}+x_{2}^{\alpha}+...........+x_{c}^{\alpha} & = & 1\\ x_{1}^{\beta}+x_{2}^{\beta}+...........+x_{c}^{\beta} & = & 1\\ ....................\\ x_{1}^{p}+x_{2}^{p}+...........+x_{c}^{p} & = & 1 \end{eqnarray}
Hemos planteado una ecuación para cada fase, tenemos p ecuaciones. Como el sistema está en equilibrio termodinámico, los potenciales químicos de cada componente en cada fase deben ser iguales:
\begin{eqnarray} \mu_{1}^{\alpha}=\mu_{1}^{\beta}=\mu_{1}^{\gamma}=.......... & = & \mu_{1}^{p}\\ \mu_{2}^{\alpha}=\mu_{2}^{\beta}=\mu_{2}^{\gamma}=.......... & = & \mu_{2}^{p}\\ .........................\\ \mu_{c}^{\alpha}=\mu_{c}^{\beta}=\mu_{c}^{\gamma}=.......... & = & \mu_{c}^{p} \end{eqnarray}
En cada fila tenemos $p-1$ igualdades, dado que hay $c$ filas, el número de ecuaciones es: $c(p-1)$
Los grados de libertad se obtienen restando variables menos ecuaciones:
\begin{equation} f=cp+2-p-c(p-1)=\cancel{cp}+2-p-\cancel{cp}+c=c-p+2 \end{equation}
Por tanto, la regla de las fases viene dada por la ecuación:
\begin{equation} f=c-p+2 \end{equation}
Ahora despreciamos la segunda suposición, ¿qué ocurrirá si algún componente no está presente en una de las fases?. Tenemos una variable menos $x_{i}^{k}$, pero también falta una relación ya que la condición de equilibrio tiene una igualdad menos. Por tanto, la regla de las fases se sigue cumpliendo.
Desechamos ahora la primera susposición, en el sistema tienen lugar $r$ reacciones químicas. Cada reacción química permite escribir una condición de equilibrio $\sum_{i}\nu_{i}\mu_{i}=0$. Esto nos da $r$ ecuaciones adicionales, dejando la regla de las fases como sigue:
\begin{equation} f=c-p+2-r \end{equation}
En algunos sistemas se pueden plantear ecuaciones adicionales. Si disolvemos NaCl en agua se debe cumplir que $n(Na^+)=n(Cl^-)$ o $x(Na^+)=x(Cl^-)$, tenemos una condición adicional denominada condición de electroneutralidad.
En un reactor que contiene $NH_3$ inicialmente, tiene lugar la reacción $2NH_3\rightleftharpoons N_2+3H_2$ en cualquier instante, incluso en el equilibrio, se cumple que $n(H_2)=3n(N_2)$. Estas nuevas ecuaciones se introducen en la regla de las fases como un parámetro a.
\begin{equation} f=c-p+2-r-a \end{equation}
Si llamamos $c_{ind}=c-r-a$, la ecuación nos queda como al principio de la deducción, $f=c_{ind}-p+2$



