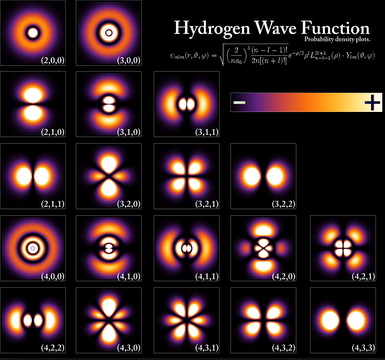
La solución de la ecuación de Schrödinger para el átomo de hidrógeno nos proporciona unas funciones de onda, llamadas orbitales, y unos niveles de energía permitidos. Dada la simetría del problema es aconsejable el uso de coordenadas esféricas ($r,\theta,\varphi$). El conjunto de funciones de onda hidrogenoides tienen la siguiente forma: \begin{equation} \psi_{nlm}(r,\theta,\varphi)=R_{nl}(r)Y_{lm}(\theta,\varphi) \end{equation}
La función $R_{nl}(r)$ se denomina función de onda radial y la función $Y_{lm}(\theta,\varphi)$ se conoce como función de onda angular y pertenece a la familia de los armónicos esféricos. n, l y m son los números cuánticos que surgen al resolver la ecuación de Schrödinger y determinan el tipo de orbital.
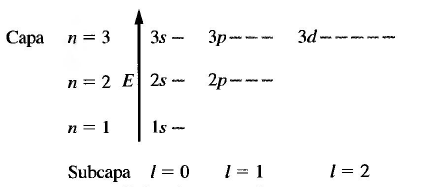
- n: número cuántico principal, toma valores enteros, positivos y distintos de cero. Representa los niveles de energía en el átomo hidrogenoide. n=1,2,3...
- l: número cuántico del momento angular orbital, toma valores comprendidos entre 0 y n-1. l=0,1,2....
- m: número cuántico magnético, está asociado a la componente z del momento angular y toma valores entre -l y +l. m=-l, -l+1,....0......l-1, l
Todos orbitales con el mismo n forman una capa o nivel electrónico y poseen la misma energía (degenerados). Los orbitales con el mismo n pero diferente l forman una subcapa o subnivel. Se acostumbra a representar las subcapas con letras, según la notación: l=0 (s); l=1 (p); l=2 (d); l=3 (f).
Las subcapas s poseen un sólo orbital cuyo valor de m=0.
Las subcapas p poseen tres orbitales, uno por cada valor que toma el número cuántico m (-1,0,1).
Las subcapas d poseen 5 orbitales correspondientes a los valores de m (-2,-1,0,1,2).
Las subcapas f se componen de 7 orbitales.
Los niveles de energía en los que se disponen los orbitales del átomo de hidrógeno vienen dados por la ecuación:
\begin{equation} E_n=-\frac{2.178x10^{-18}}{n^2}J \end{equation}
Todos los orbitales situados en la misma capa (mismo valor de n) poseen identica energía.
En la siguiente imagen podemos ver los mapas de color que nos dan las zonas de mayor densidad electrónica y que perfilan el contorno del los distintos orbitales hidrogenoides.