La configuración electrónica de un átomo nos indica como se distribuyen los electrones en las diferentes capas, subcapas y orbitales. Esta distribución está relacionada con las propiedades físicas de los elementos. Para escribir la configuración electrónica de un átomo polielectrónico utilizaremos tres reglas: 1/ Regla de llenado o aufbau; 2/ Principio de exclusión de Pauli; 3/ Regla de Hund de la máxima multiplicidad.
- Regla de llenado o aufbau. Los electrones ocupan los orbitales de manera que se minimice la energía del átomo. Es decir, primero se ocupan los niveles de menor energía. El orden de llenado de las diferentes subcapas se obtiene mediante el siguiente diagrama en el que debemos comenzar por la linea superior e ir siguiendo las flechas.
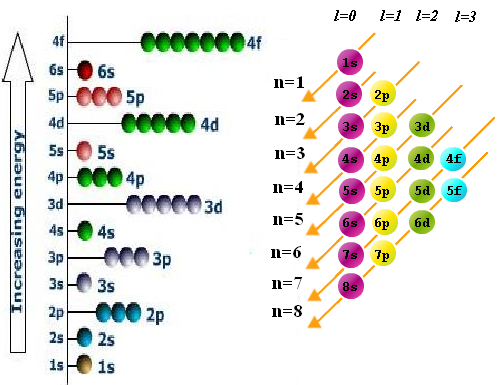
- Principio de exclusión de Pauli. Dos electrónes de un átomo no pueden tener los cuatro números cuánticos iguales. Los números cuánticos n,l y m determinan un orbital en el que solo pueden entrar dos electrones con valores diferentes de $m_s$.
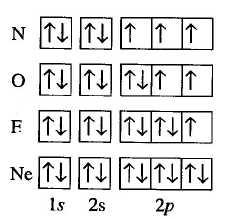
- La regla de Hund de la máxima multiplicidad nos dice que los orbitales de igual energía se van ocupando con un electrón (semillenan), una vez semiocupados se comienza el llenado.
En la siguiente imagen podemos ver la aplicación del principio de Pauli y la regla de Hund al llenado de orbitales para nitrógeno, oxígeno, flúor y neon..
Ahora vamos a escribir la configuración electrónica de algunos átomos basándonos en las reglas anteriores:
H: $1s^1$
He: $1s^2$
Li: $1s^22s^1$
Be: $1s^22s^2$
B: $1s^22s^22p^1$
C: $1s^22s^22p^2$
N: $1s^22s^22p^3$
O: $1s^22s^22p^4$
F: $1s^22s^22p^5$
Ne: $1s^22s^22p^6$
Na: Ne: $1s^22s^22p^63s^1$
Mg: $1s^22s^22p^63s^2$
Al: $1s^22s^22p^63s^23p^1$
Si: $1s^22s^22p^63s^23p^2$
P: $1s^22s^22p^63s^23p^3$
S: $1s^22s^22p^63s^23p^4$
Cl: $1s^22s^22p^63s^23p^5$
Ar: $1s^22s^22p^63s^23p^6$



