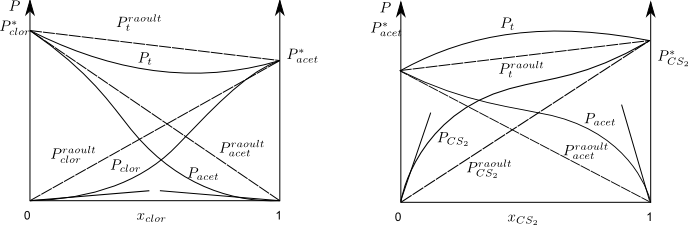
Desviaciones negativas respecto a la Ley de Raoult.
La disolución acetona-cloroformo presenta unas presiones de vapor inferiores a las que predice la Ley de Raoult. Esta desviación es debida a que las fuerzas intermoleculares son mayores en la disolución que en los componentes puros.
Como puede observarse en la gráfica para fracciones molares de cloroformo próximas a 1, el cloroformo cumple la Ley de Raoult mientras que la acetona cumple la Ley de Henry.
Para fracciones molares de cloroformo próximas a 0, la acetona cumple la Ley de Raoult y el cloroformo la de Henry.
Desviaciones positivas respecto a Raoult
La disolución acetona-disulfuro de carbono presenta presenta presiones de vapor superiores a las que predice Raoult, debio a que las fuerzas intermoleculares en la disolución son menores que en los componentes puros.